Benralizumab: Der IL-5-Rezeptor als Ziel bei schwerem eosinophilem Asthma
Abstract
Zusammenfassung. Für Patienten mit schwierig kontrollierbarem, schwerem Asthma bronchiale stehen heute neben der inhalativen Medikation hochwirksame, gezielte Behandlungsmöglichkeiten zur Verfügung. Bei Vorliegen einer deutlichen Eosinophilie verspricht die Hemmung der Interleukin-5-Achse (IL‑5) mit spezifischen, monoklonalen Antikörpern eine wirksame und nebenwirkungsarme Alternative zur dauerhaften systemischen Steroidtherapie. In diesem Übersichtsartikel werden die Daten zu Benralizumab, einem spezifischen Antikörper gegen den IL-5-Rezeptor Alpha, zusammengefasst. Dieser Angriffspunkt verhindert die Rezeptorstimulation durch IL-5 und aktiviert eine NK-zellvermittelte zytotoxische Reaktion, die zur Apoptose der eosinophilen Granulozyten führt. Die s.c.-Applikation von Benralizumab führt innerhalb von Tagen zur nahezu vollständigen Depletion der Eosinophilen im Blut mit konsekutiver Verbesserung der Lungenfunktion und Stabilisierung des Asthmas. Für ausgewählte Patienten mit schwerem Asthma eröffnet sich hier eine vielversprechende Therapie-Option.
Abstract. For patients with difficult-to-control, severe bronchial asthma, highly effective, targeted treatment options are available in addition to inhaled medication. In the presence of eosinophilia, inhibition of the interleukin-5 (IL‑5) axis with specific monoclonal antibodies promises to be an effective alternative to continuous systemic steroid therapy with few side effects. This review summarizes the data on benralizumab, a specific antibody against the IL-5 receptor alpha preventing receptor stimulation by IL-5 and activating a NK-cell mediated cytotoxic reaction with apoptosis of eosinophils. The s.c.-application of benralizumab leads within days to a virtually complete depletion of blood eosinophils with consecutive improvement in lung function and stabilization of asthma. For selected severe asthmatics, this is a promising therapy option.
Résumé. Pour des patients asthmatiques sévères et difficiles à contrôler, il existe de nouvelles thérapies très efficaces qui complémentent le traitement par inhalation. En cas d’éosinophilie sanguine, l’inhibition de l’axe interleukine-5 avec des anticorps monoclonaux spécifiques représente une alternative bien tolérée aux hautes doses prolongées de corticostéroïdes systémiques. Cette revue résume les données sur le benralizumab, un anticorps monoclonal contre le récepteur IL-5 alpha (IL-5R). Le benralizumab inhibe la stimulation du IL-5R et déclenche une réaction cytotoxique transmise par les NK-cellules résultant en une apoptose des éosinophiles. L’administration s.c. de benralizumab réduit fortement en l’espace de quelques jours les éosinophiles circulants avec amélioration de la fonction pulmonaire et stabilisation consécutive de l’asthme. Ce traitement représente une approche thérapeutique prometteuse pour des asthmatiques sévères sélectionnés.
Pathologie des schweren eosinophilen Asthmas
Im Artikel verwendete Abkürzungen
ADA Anti-Drug-Antikörper
ADCC Antibody-dependent cell-mediated cytotoxicity
ATS American Thoracic Society
COPD Chronic Obstructive Pulmonary Disease
ECP Eosinophil Cationic Protein
EDN Eosinophil-Derived Neurotoxin
ERS European Respiratory Society
FVC Forcierte Vitalkapazität
HES Hypereosinophiles Syndrom
ICS Inhalative Kortikosteroide
IgE Immunglobulin E
IL-5 Interleukin-5
IL-5Rα Interleukin-5-Rezeptor Alpha
ILC2 Type-2 Innate Lymphoid Cells
i.v. Intravenös
LABA Langwirksame β 2-Agonisten
NK Natürliche Killerzellen
NSAID Nicht-steroidale entzündungshemmende Medikamente
OCS Orale Kortikosteroide
OSA Obstruktive Schlafapnoe
s.c. Subkutan
UE Unerwünschtes Ereignis
Asthma als chronisch entzündliche Erkrankung der Atemwege betrifft ca. 6–10 % der Bevölkerung westlicher Länder. Etwa 5–10 % der Patienten leiden an schwerem Asthma, d.h. chronisch persistierenden Symptomen und wiederkehrenden Exazerbationen. In dieser schwierig zu behandelnden Patientensubgruppe bleibt das Asthma also unkontrolliert, was einen relativ grossen Teil der mit Asthma verbundenen Morbiditäts- und Gesundheitskosten verursacht – eine erhebliche Belastung für das Gesundheitssystem und die Gesellschaft [1, 2, 3, 4, 5]. Die heterogene Pathophysiologie des Asthmas beruht auf dem Zusammenspiel zwischen einer zugrundeliegenden zellulären Entzündung, Obstruktion des Atemflusses aufgrund einer Bronchokonstriktion, Hypersekretion von zähem Schleim sowie einer Überempfindlichkeit der Atemwege, die sich in klinischen Symptomen wie Kurzatmigkeit, pfeifendes Atemgeräusch, Engegefühl im Brustkorb, Husten und nächtlichem Erwachen äussert [3, 6].
Für etwa 50 % der Patienten mit schwerem Asthma ist die eosinophile Entzündung ein Charakteristikum der Erkrankung [7], die mit dem Asthmaschweregrad, der Symptombelastung einschliesslich einer höheren Exazerbationsrate und eingeschränkter Lungenfunktion verbunden ist [8, 9, 10]. Eosinophiles Asthma tritt im Wesentlichen in zwei Patienten-Untergruppen auf, dem Allergic Early-Onset Asthma und dem meist nicht durch IgE vermittelten Eosinophilic Adult-Onset Asthma, die beide zum Signalweg der Typ‑2-Immunantwort gehören [11]. Letzteres wurde erstmals vor genau 100 Jahren als eigenständiger Phänotyp beschrieben. Im Gegensatz zum allergischen Asthma, das durch inhalierte Allergene verursacht wird, wurde es anfänglich als intrinsisches Asthma bezeichnet [12]. Moderne Clusteranalysen konnten diese letztgenannte Entität auch bestätigen [13]. Das Eosinophilic Adult-Onset Asthma ist durch eine erste Manifestation im Erwachsenenalter, mehrjährige Symptome und die Beteiligung der oberen Atemwege an der eosinophilen Entzündung gekennzeichnet. Neben der chronischen Rhinosinusitis entstehen oft Nasenpolypen mit steroidempfindlicher Anosmie und einer Unverträglichkeitsreaktion gegenüber Acetylsalicylsäure und nicht-steroidalen entzündungshemmenden Medikamenten (NSAID). Klinisch ist die bronchiale Überempfindlichkeit oft gering, sodass typische Asthmasymptome fehlen können und das Risiko einer Verwechslung mit der COPD hoch ist. Die Bronchialobstruktion erweist sich nur dann als reversibel, wenn nach einer in solchen Fällen meist nachweisbaren Bluteosinophilie aktiv gesucht und eine Behandlung mit Kortikosteroiden eingeleitet wird. Das Erreichen einer niedrigen Anzahl eosinophiler Granulozyten bei schweren eosinophilen Asthmapatienten durch die Behandlung mit oralen Kortikosteroiden (OCS) führt zu weniger Exazerbationen und Hospitalisierungen [14]. Während dies bei einigen allergischen Asthmatikern mit dem Anti-IgE-Antikörper Omalizumab erreicht werden kann, kann auch die eosinophile Entzündung direkt durch die Reduktion der Eosinophilenzahl bekämpft werden [15]. Interleukin-5 (IL-5) stellt neben anderen hier ein Schlüsselzytokin dar, weil es bei der Entwicklung, Reifung im Knochenmark, Aktivierung und dem Überleben der eosinophilen Granulozyten von zentraler Bedeutung ist [16, 17]. Zudem ist die IL-5-Konzentration in der Lunge von Asthmapatienten erhöht [18]. Die Blockierung der Wirkung dieses Zytokins oder die direkte Depletion der Eosinophilen scheinen daher attraktive Ansätze zur Behandlung von schwerem eosinophilem Asthma zu sein.
Nach den internationalen ATS/ERS-Leitlinien benötigen Patienten mit schwerem Asthma derzeit hochdosierte inhalative Kortikosteroide (ICS) in Kombination mit langwirksamen β 2-Agonisten (LABA) als Standardtherapie zur Kontrolle ihrer Erkrankung [19]. Trotz nachgewiesener Wirksamkeit dieses Ansatzes für die meisten Asthmatiker haben viele schwergradige Asthmapatienten nach wie vor einen unkontrollierten Krankheitsstatus. Sie sind weiterhin dem Risiko wiederkehrender Exazerbationen ausgesetzt, die zu schweren Symptomen, Hospitalisierungen, verminderter Lebensqualität, erhöhtem Ressourcenverbrauch im Gesundheitswesen sowie Kosten führen [20, 21, 22]. Darüber hinaus benötigen 32–45 % dieser Patienten eine häufige oder permanente Therapie mit systemischen Glukokortikoiden, damit ihr Asthma trotz Standardbehandlung kontrolliert bleibt [23, 24]. Zu den schwerwiegenden langfristigen Nebenwirkungen von OCS gehören Typ-2-Diabetes, Osteoporose, dyspeptische Beschwerden, Fettleibigkeit, Bluthochdruck, Katarakt und obstruktive Schlafapnoe (OSA) [25]. Effektive alternative Therapieoptionen zur Reduktion der OCS-Exposition ohne solche Nebenwirkungen werden zunehmend als Bedürfnis erkannt [26]. Die rasche und dauerhafte Kontrolle der Krankheit ist für diese Patienten sehr erstrebenswert, da sie in ihrem Alltag und insbesondere in ihrer Lebensqualität stark beeinträchtigt sind.
Benralizumab-Therapie: Wirkmechanismus
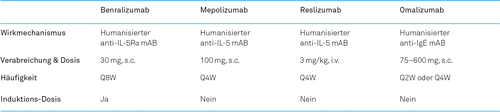
In der Schweiz wurden bisher vier monoklonale Antikörper als biologische Behandlungsoption zugelassen: Mepolizumab, Reslizumab und Benralizumab bei schwerem eosinophilem Asthma und Omalizumab zur Behandlung von schwerem, unkontrolliertem, IgE-vermitteltem, allergischem Asthma (Tabelle 1). Die durchschnittlichen Jahreskosten einer Behandlung mit Biologika liegen in der Schweiz ungefähr zwischen 18 000.– und 20 500.– CHF, wobei es zu erheblichen Abweichungen kommen kann, wie z.B. aufgrund des Körpergewichts oder des IgE-Spiegels.
Benralizumab ist ein humanisierter, afucosylierter, monoklonaler Antikörper, der spezifisch an die IL-5-Rezeptor-Alpha-Untereinheit (IL-5Rα) auf eosinophilen und basophilen Granulozyten bindet (Abb. 1) [27, 28]. Afucosylierung, die Eliminierung der Fucose-Zucker aus den Oligosacchariden im Fc‑Bereich von Benralizumab, erhöht die Bindungsaffinität zum Fc‑Rezeptor auf natürlichen Killerzellen (NK). Zusätzlich zur Blockierung des Zugangs zum IL-5Rα rekrutiert Benralizumab direkt NK-Zellen, was in einer aktiven Apoptose der Eosinophilen über eine erhöhte antikörperabhängige, zellvermittelte Zytotoxizität (antibody‑dependent cell-mediated cytotoxicity, ADCC) resultiert [17, 29]. Die ADCC-Induktion ist der zentrale therapeutische Effekt von Benralizumab. Sie führt zu einer direkten, schnellen und nahezu vollständigen Depletion der Eosinophilen im peripheren Blut und Knochenmark sowie zu einer signifikanten numerischen Abnahme im Sputum (-90 %) und in der Schleimhaut der Atemwege (-96 %) [30].
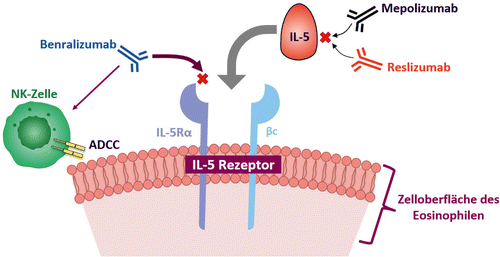
Im Gegensatz dazu binden die humanisierten monoklonalen Antikörper Mepolizumab und Reslizumab zirkulierendes IL-5 und verhindern so eine Interaktion mit dem IL-5R (Abb. 1). Dieser indirekte Mechanismus hemmt die Aktivierung der Eosinophilen und führt zu einer Reduktion der Zellzahlen durch passive Apoptose aufgrund einer verringerten IL-5-Stimulation [32]. Beide Biologika reduzieren die Anzahl der Eosinophilen im Blut und Sputum signifikant [33, 34]. Antizytokin-Mechanismen können jedoch zu einer weniger vollständigen Depletion der Eosinophilen in den Atemwegen führen im Vergleich zu einer gezielten ADCC über den IL-5R durch Benralizumab, da auch andere aktivierende Zytokine (z.B. IL-13) die Lebensfähigkeit der Eosinophilen stimulieren können. So wurde in klinischen Studien mit Mepolizumab gezeigt, dass auch nach Verabreichung hoher i.v.-Dosen von Mepolizumab trotz signifikanter klinischer Wirkung eine substanzielle Restsputum-Eosinophilie vorhanden sein kann [35, 36]. In einer Subanalyse von OCS-abhängigen Patienten mit schwerem Asthma gab es nur einen Trend zur Reduktion der im Sputum vorkommenden Eosinophilen nach Verabreichung von Mepolizumab, ohne die Anzahl der eosinophilen Vorläuferzellen im Sputum zu beeinflussen [37]. Die gewichtsabhängige i.v.-Dosierung von Reslizumab scheint in dieser Hinsicht effektiver mit einer Reduktion der Sputum-Eosinophilen um 95 % [33].
Pharmakokinetik und -dynamik
Die Depletion zirkulierender Eosinophilen nach der Verabreichung von Benralizumab erfolgt schnell, mit einem Wirkungseintritt innerhalb von 24 Stunden, wie in klinischen Studien der Phase I & II bei schwerem Asthma bestätigt wurde (Abb. 2) [27, 29, 30, 38]. Zudem wurde die Depletion der Eosinophilen nach Administration von Benralizumab von einer signifikanten Reduktion des im Serum von Asthmapatienten gemessenen Eosinophil Cationic Protein (ECP) sowie des Eosinophil‑Derived Neurotoxin (EDN) begleitet. Dies deutet darauf hin, dass nach der eosinophilen Apoptose keine sekundäre Nekrose auftritt und keine zytotoxischen Granulaproteine freigesetzt werden [38, 39].
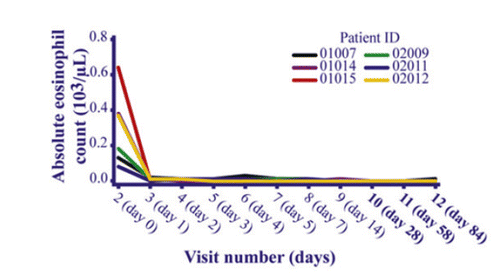
Nach Beendigung einer 40-wöchigen Behandlungszeit kehrte die Eosinophilenzahl im Blut bis zur Woche 66 fast auf Basiswerte zurück [41]. Das pharmakokinetische Profil verhielt sich in einer 0,03–3 mg/kg i.v.-Dosierungsstudie ungefähr dosislinear, mit einer mittleren Eliminationshalbwertszeit von Benralizumab im Bereich von zwei bis drei Wochen [27, 41]. Benralizumab wird unspezifisch durch proteolytische Enzyme abgebaut, die im gesamten Körper vorkommen und nicht auf hepatisches Gewebe beschränkt sind.
Insgesamt entwickelte sich bei 13 % der mit Benralizumab über 48–56 Wochen behandelten Patienten eine Anti-Drug-Antikörper (ADA) Reaktion. Bei der Mehrheit der ADA-positiven Patienten wurden in vitro neutralisierende Antikörper nachgewiesen. Anti-Benralizumab-Antikörper waren mit einem verstärkten Abbau von Benralizumab und erhöhten Werten von Eosinophilen im Blut verbunden. Es wurden keine Hinweise auf eine Assoziation zwischen ADA und der Wirksamkeit sowie Sicherheit beobachtet [42].
Benralizumab: klinisches Studienprogramm
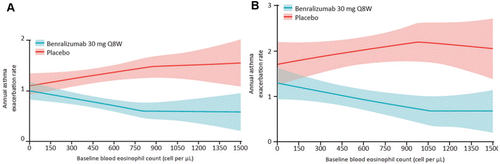
Das WINDWARD-Programm in Asthma umfasst sechs Phase-III-Studien mit 3068 Patienten an 798 Studienzentren in 26 Ländern, das bisher grösste Phase- III-Entwicklungsprogramm für ein Biologikum gegen Atemwegserkrankungen. Die beiden ausschlaggebenden Zulassungsstudien SIROCCO [43] und CALIMA [44] sind randomisierte, doppelblinde, Parallelgruppen, und placebokontrollierte Studien zur Evaluierung der Wirksamkeit und Sicherheit zweier Dosisregime von Benralizumab als Zusatztherapie gegen schweres unkontrolliertes Asthma bei Vorliegen einer eosinophilen Entzündung und einer Vorgeschichte von Asthma-Exazerbationen. Die primäre Analysepopulation umfasste Patienten im Alter von zwölf Jahren oder älter, die hochdosiertes ICS/LABA erhielten, bei einem eosinophilen Basis-Blutwert von ≥300 Zellen/Mikroliter (µl), mit oder ohne OCS und zusätzliche Asthma-Kontrollmedikation. Die Patienten wurden randomisiert, um subkutanes Benralizumab 30 mg alle vier Wochen (Q4W), 30 mg alle vier Wochen für die ersten drei Dosen, gefolgt von 30 mg alle acht Wochen (Q8W), oder Placebo für bis zu 56 Wochen zu erhalten. Benralizumab wurde gut vertragen, reduzierte die Asthma-Exazerbationen um bis zu 51 % und verbesserte die Lungenfunktion (FEV1: +159 ml in SIROCCO bzw. +116 ml in CALIMA vs. Placebo) sowie die Krankheitskontrolle bei Patienten mit schwerem, unkontrolliertem Asthma. Im Allgemeinen schnitt das Q8W-Regime bei den meisten Endpunkten numerisch besser ab als das Q4W-Regime. Eine gepoolte Analyse dieser beiden Studien zeigte, dass die Wirkung von Benralizumab bei Patienten mit höherer Bluteosinophilie und einer Vorgeschichte von vermehrten Exazerbationen stärker ausgeprägt war (Abb. 3) [45]. Darüber hinaus waren der Gebrauch von OCS, das Vorhandensein von Polyposis nasi und die forcierte Vitalkapazität (FVC) <65 % Soll mit einem besseren Ansprechen auf die Benralizumab-Behandlung assoziiert. Vor allem Patienten mit ≥300 Eosinophilen/µl Blut wiesen eine stärkere Reduktion der Exazerbationen und eine Verbesserung der Lungenfunktion sowie der Asthmasymptome auf [46].
Die dritte Zulassungsstudie, ZONDA [47], zeigte eine signifikante und klinisch bedeutsame Reduktion der oralen Steroiddosis im Vergleich zu Placebo bei Patienten mit schwerem, unkontrolliertem, OCS-abhängigem eosinophilem Asthma. Die mit Benralizumab behandelten Patienten erreichten eine mittlere Reduktion der OCS-Dosis um 75 % bei gleichbleibender Asthmakontrolle, wobei die Exazerbationsrate um 70 % und die Hospitalisierungen um 93 % reduziert wurden.
Die Sicherheits- und Verträglichkeitsergebnisse für Benralizumab stimmten im Wesentlichen mit denen früherer Studien überein. Die Häufigkeit von unerwünschten Ereignissen (UE) war in den beiden Benralizumab-Gruppen und der Placebo-Gruppe ähnlich, wobei die häufigsten UE eine Verschlechterung des Asthmas, Nasopharyngitis und Bronchitis waren. Die kürzlich publizierte Sicherheits-Verlängerungsstudie (Safety Extension Study) BORA mit einer Dauer von bis zu 130 Wochen bestätigte das vorteilhafte Sicherheitsprofil von Benralizumab mit nachhaltiger Exazerbationsreduktion: 72 % der Patienten im 8-wöchigen Benralizumab-Regime mit mehr als 300 Eosinophilen/µl waren exazerbationsfrei, verglichen mit den drei Zulassungsstudien [48]. Zusätzlich zeigte die ALIZE-Studie, dass Benralizumab die Immunantwort auf die Grippeimpfung nicht beeinträchtigt [49].
Gegenwärtiger Wissensstand über die langfristige Depletion der Eosinophilen
Trotz des Fehlens bedeutender Sicherheitssignale ist die Frage relevant, welche weitreichenden Folgen die langfristige Depletion der Eosinophilen haben könnte, da die Entwicklung dieses Zelltyps evolutionsgeschichtlich einen bestimmten Zweck haben muss. Eosinophile sind mit der Immunantwort auf helminthische Parasiteninfektionen verbunden, aber ihre Rolle bei der Abwehr anderer mikrobieller Infektionen ist weiterhin unklar [50]. Es gibt jedoch Hinweise darauf, dass Eosinophile antivirale, antibakterielle sowie antimykotische Aktivitäten zeigen [51]. Darüber hinaus sind Eosinophile konstitutionell in der Schleimhaut des Magen-Darm-, Atmungs- und Urogenitaltraktes zu finden und spielen möglicherweise eine Rolle in der Interaktion mit dem Mikrobiom. Das Vorhandensein von Eosinophilen im Darmtrakt wurde im Rahmen der Mepolizumab-Entwicklung untersucht, wo gezeigt wurde, dass die Anti-IL-5-Behandlung keinen Einfluss auf die Infiltration der Eosinophilen in das Duodenum hatte [52]. Solche Daten sind für Benralizumab bislang nicht verfügbar.
Die Rolle von Eosinophilen bei der Immunüberwachung von Malignomen ist ebenfalls nicht gut verstanden [53]. Die Anwesenheit von Eosinophilen wurde sowohl mit pro-karzinogenen als auch mit anti-karzinogenen Wirkungen in Verbindung gebracht, sowohl in nicht-klinischen als auch klinischen Studien [54]. Infektionen (insbesondere helminthische Parasiten) und Malignome stellen daher derzeit ein potenzielles Risiko der Eosinophilen-Depletion dar. In den drei zulassungsrelevanten Phase-III-Studien mit Benralizumab wurden Personen mit einer bekannten Vorgeschichte hinsichtlich Helmintheninfektionen ausgeschlossen. Im Laufe der Studien und der langfristigen Nachbeobachtung wurden jedoch keine Helmintheninfektionen beobachtet.
In Mäusen [55] und anschliessend in nicht-menschlichen Primaten [56] konnte man zeigen, dass die Depletion der Eosinophilen durch eine bis zu sechs Monate dauernde Intervention mit dem monoklonalen Anti-IL-5-Antikörper TRFK5 die Gesundheit und Langlebigkeit dieser Tiere nicht beeinträchtigt. Darüber hinaus existieren seit Jahrzehnten Mausstämme, die durch eine Deletion in einer GATA-Bindungsstelle des GATA-1 Promotors keine eosinophilen Granulozyten ausbilden können. Diese Mäuse zeigten keine Unterschiede in der pathogenvermittelten Reaktion im Vergleich zu Wildtyp-Mäusen [57], werden allerdings unter pathogenfreien Bedingungen gehalten und sind daher nicht mit der menschlichen Situation vergleichbar.
Die Behandlung des hypereosinophilen Syndroms (HES) mit Mepolizumab über bis zu sechs Jahre deutet darauf hin, dass Patienten die Anti-IL-5-Therapie ohne erkennbare Sicherheitsrisiken gut vertragen [58]. Die zusätzliche Safety Extension Study MELTEMI wird einen weiteren Beitrag zur Diskussion über die langfristige Sicherheit der eosinophilen Depletion mit Benralizumab leisten [59].
Fazit und Ausblick
Vielversprechende neue Behandlungsmöglichkeiten für schwergradige Asthmapatienten mit Eosinophilie sind derzeit verfügbar. Die Blockierung des IL-5-Rezeptor Alpha mit nachfolgender ADCC-Induktion durch Benralizumab erwies sich als wirksam und sicher und ermöglicht eine bessere Asthmakontrolle sowie Lebensqualität für diese schwierig zu behandelnde Patientengruppe. Laufende Studien befassen sich mit dem zeitlichen Verlauf der Änderung der Lungenfunktion (SOLANA) [60] sowie der Asthma-Exazerbationsrate und der Lebensqualität in Patienten mit schwerem Asthma, die trotz Standardbehandlung unkontrolliert sind (ANDHI) [61]. Mit der PONENTE-Studie wird die Möglichkeit untersucht, den chronischen OCS-Verbrauch nach der Initiierung von Benralizumab in einem pragmatischen Open-Label-Setting zu reduzieren [62], da die langfristigen Nebenwirkungen von OCS ein signifikantes Problem in dieser schwergradigen Asthmapopulation darstellen.
- •Schwergradiges Asthma ist nicht sehr häufig; die Betroffenen leiden aber unter der oft unkontrollierten Situation mit entsprechender Asthma-assoziierter Morbidität.
- •In etwa 50 % der schwergradigen Asthmapatienten findet sich eine Bluteosinophilie, die mit dem Asthmaschweregrad, den Asthmasymptomen, der Exazerbationshäufigkeit und der reduzierten Lungenfunktion assoziiert ist.
- •Bei schwergradigem Asthma mit Bluteosinophilie ist Benralizumab, ein spezifischer monoklonaler Antikörper gegen den IL-5-Rezeptor Alpha, eine wirksame und nebenwirkungsarme Add-on-Therapie zusätzlich zu hochdosierten inhalativen Kortikosteroiden und langwirksamen Beta-2-Mimetika.
Lernfragen
1. Wie hoch ist die Prävalenz von Asthma in der Schweiz? (Einfachauswahl)
- a)2–6 %
- b)6–10 %
- c)10–15 %
- d)15–20 %
2. Wie hoch ist der Anteil an Patienten mit schwerem Asthma, die zusätzlich zur inhalativen Behandlung häufig oder permanent systemische Kortikosteroide (OCS) benötigen? (Einfachauswahl)
- a)5–12 %
- b)15–24 %
- c)32–45 %
- d)47–56 %
3. Was ist die zentrale therapeutische Wirkung von Benralizumab? (Einfachauswahl)
- a)Blockierung von IL-13
- b)Blockierung des IL-5-Rezeptor Alpha mit anschliessender NK-zellvermittelter Apoptose der eosinophilen Granulozyten (ADCC)
- c)Blockierung des IL-5-Rezeptor Alpha mit anschliessender Nekrose der eosinophilen Granulozyten
- d)Blockierung von IL-5
Antworten zu den Lernfragen:
1. Antwort b) ist richtig.
2. Antwort c) ist richtig.
3. Antwort b) ist richtig.
Jörg D. Leuppi erhält unregistered Forschungs-Grants von AstraZeneca, Boehringer Ingelheim, Mundipharma und Novartis.
Peter Schmid-Grendelmeier hat als Referent oder Berater Honorare von Abionic, ALK Abello, Allergopharma, AstraZeneca, Bencard, Euroimmun, GSK, Novartis, Stallergenes, Teva und Thermo Fisher Diagnostics erhalten. Zudem hat er von AstraZeneca und Novartis mitfinanzierte Studien durchgeführt.
T. Rothe hat Honorare für Vortrags- und Beratungstätigkeiten für AstraZeneca, GSK, Novartis und Teva erhalten.
C. von Garnier hat von AstraZeneca, Boehringer Ingelheim, GSK, Mundipharma, Novartis, Pfizer, PneumRx und Pulmonx Honorare für Vorträge und Beratungstätigkeiten erhalten.
Markus Solèr hat an Advisory Boards für AstraZeneca und GSK teilgenommen sowie Vortragshonorare von Novartis erhalten.
Bibliografie
Global Initiative for Asthma (GINA) . Global Strategy for Asthma Management and Prevention, 2018. https://ginasthma.org/gina-reports; letzter Zugriff: 01.06.2018.: Trustworthy guidelines on severe asthma thanks to the ERS and ATS.
Eur Respir J 2014; 43: 315–318., : International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma.
Eur Respir J 2014; 43: 343–373.: Asthma control in Switzerland: a general practitioner based survey.
Curr Med Res Opin 2006; 22: 2159–2166., : Global asthma prevalence in adults: findings from the cross-sectional world health survey.
BMC Public Health 2012;12:204.: Innate and adaptive immune responses in asthma.
Nat Med . 2012; 18: 673–683.: Tissue and BAL based biomarkers in asthma.
Immunol Allergy Clin North Am 2007; 27: 623–632; vi.: The relationship between airways inflammation and asthma severity.
Am J Respir Crit Care Med 2000; 161: 9–16., : Predicting frequent asthma exacerbations using blood eosinophil count and other patient data routinely available in clinical practice.
J Asthma Allergy 2016; 9: 1–12., : Sputum eosinophilia is a determinant of FEV1 decline in occupational asthma: results of an observational study.
BMJ Open 2015; 5: e005748., : Precision medicine in patients with allergic diseases: Airway diseases and atopic dermatitis-PRACTALL document of the European Academy of Allergy and Clinical Immunology and the American Academy of Allergy, Asthma & Immunology.
J Allergy Clin Immunol 2016; 137: 1347–1358.: A clinical study of one hundred and fifty cases of bronchial asthma.
Arch Intern Med (Chic) 1918; 2: 517–522., : Cluster analysis and clinical asthma phenotypes.
Am J Respir Crit Care Med 2008; 178: 218–224., : Asthma exacerbations and sputum eosinophil counts: a randomised controlled trial.
Lancet 2002; 360: 1715–1721., : Oral corticosteroid sparing with omalizumab in severe allergic (IgE-mediated) asthma patients.
Curr Med Res Opin 2011; 27: 2223–2228.: Molecular and clinical rationale for therapeutic targeting of interleukin-5 and its receptor.
Clin Exp Allergy 2012; 42: 712–737.: The past, present, and future of monoclonal antibodies to IL-5 and eosinophilic asthma: a review.
J Asthma Allergy 2015; 8: 125–134., : Predominant TH2-like bronchoalveolar T-lymphocyte population in atopic asthma.
N Engl J Med 1992; 326: 298–304., : Overall asthma control: the relationship between current control and future risk.
J Allergy Clin Immunol 2010; 125: 600–608, 8 e1–8 e6., : Risk factors for death in patients with severe asthma.
J Bras Pneumol 2014; 40: 364–372.: Uncontrolled asthma: a review of the prevalence, disease burden and options for treatment.
Respir Med 2006; 100: 1139–1151., : Direct health care costs associated with asthma in British Columbia.
Can Respir J 2010; 17: 74–80., : Characterization of the severe asthma phenotype by the National Heart, Lung, and Blood Institute’s Severe Asthma Research Program.
J Allergy Clin Immunol 2007; 119: 405–413., : Clinical and inflammatory characteristics of the European U-BIOPRED adult severe asthma cohort.
Eur Respir J 2015; 46: 1308–1321., : Comorbidity in severe asthma requiring systemic corticosteroid therapy: cross-sectional data from the Optimum Patient Care Research Database and the British Thoracic Difficult Asthma Registry.
Thorax 2016; 71: 339–346.: Novel targeted therapies for eosinophil-associated diseases and allergy.
Annu Rev Pharmacol Toxicol 2015; 55: 633–656., : Safety profile, pharmacokinetics, and biologic activity of MEDI-563, an anti-IL-5 receptor alpha antibody, in a phase I study of subjects with mild asthma.
J Allergy Clin Immunol 2010; 125: 1237–1244.: Benralizumab: a unique IL-5 inhibitor for severe asthma.
J Asthma Allergy 2016; 9: 71–81., : MEDI-563, a humanized anti-IL-5 receptor alpha mAb with enhanced antibody-dependent cell-mediated cytotoxicity function.
J Allergy Clin Immunol 2010; 125: 1344–1353., : Effects of benralizumab on airway eosinophils in asthmatic patients with sputum eosinophilia.
J Allergy Clin Immunol 2013; 132: 1086–1096.: Interleukin-5 pathway inhibition in the treatment of eosinophilic respiratory disorders: evidence and unmet needs.
Curr Opin Allergy Clin Immunol 2016; 16: 186–200.: Direct demonstration of delayed eosinophil apoptosis as a mechanism causing tissue eosinophilia.
J Immunol 1997; 158: 3902–3908., : Reslizumab for poorly controlled, eosinophilic asthma: a randomized, placebo-controlled study.
Am J Respir Crit Care Med 2011; 184: 1125–1132., : Mepolizumab and exacerbations of refractory eosinophilic asthma.
N Engl J Med 2009; 360: 973–984.: Eosinophil’s role remains uncertain as anti-interleukin-5 only partially depletes numbers in asthmatic airway.
Am J Respir Crit Care Med 2003; 167: 199–204., : Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, double-blind, placebo-controlled trial.
Lancet 2012; 380: 651–659., : Role of local eosinophilopoietic processes in the development of airway eosinophilia in prednisone-dependent severe asthma. Clin Exp Allergy 2016; 46: 793–802.
: Reductions in eosinophil biomarkers by benralizumab in patients with asthma.
Respir Med 2016; 111: 21–29., : A randomized trial of benralizumab, an antiinterleukin 5 receptor alpha monoclonal antibody, after acute asthma.
Am J Emerg Med 2015; 33: 14–20.Fachinformation: http://www.swissmedicinfo.ch/; letzter Zugriff: 17.09.2018.
, : Benralizumab, an anti-interleukin 5 receptor alpha monoclonal antibody, versus placebo for uncontrolled eosinophilic asthma: a phase 2b randomised dose-ranging study.
Lancet Respir Med 2014; 2: 879–890.Fasenra . Prescribing Information on Fasenra™: https://www.fasenra.com/; letzter Zugriff: 19.06.2018., : Efficacy and safety of benralizumab for patients with severe asthma uncontrolled with high-dosage inhaled corticosteroids and long-acting beta2-agonists (SIROCCO): a randomised, multicentre, placebo-controlled phase 3 trial.
Lancet 2016; 388: 2115–2127., : Benralizumab, an anti-interleukin-5 receptor alpha monoclonal antibody, as add-on treatment for patients with severe, uncontrolled, eosinophilic asthma (CALIMA): a randomised, double-blind, placebo-controlled phase 3 trial.
Lancet 2016; 388: 2128–2141., : Predictors of enhanced response with benralizumab for patients with severe asthma: pooled analysis of the SIROCCO and CALIMA studies.
Lancet Respir Med 2018; 6: 51–64., : Baseline patient factor impact on the clinical efficacy of benralizumab for severe asthma.
Eur Respir J 2018; 52 pii: 1800936. doi: 10.1183/13993003.00936-2018., : Oral glucocorticoid-sparing effect of benralizumab in severe asthma.
N Engl J Med 2017; 376: 2448–2458., :
Long-term safety and efficacy of benralizumab in patients with severe, uncontrolled asthma: 1-year results from the BORA phase 3 extension trial .Lancet Respir Med 2019; 7: 46–45., : No effect of benralizumab treatment on antibody response to seasonal influenza vaccination in adolescent and young adult patients with moderate to severe asthma: results from the phase IIIb ALIZE trial.
J Asthma Allergy 2018; 11: 181–192.: The role of eosinophils in host defense against helminth parasites.
J Allergy Clin Immunol 2004; 113: 30–37.: The consequences of not having eosinophils.
Allergy 2013; 68: 829–835.: Mepolizumab does not alter levels of eosinophils, T cells, and mast cells in the duodenal mucosa in eosinophilic esophagitis.
J Allergy Clin Immunol 2010; 126: 175–177.: Eosinophils and cancer.
Cancer Immunol Res 2014; 2: 1–8.: The expanding role(s) of eosinophils in health and disease.
Blood 2012; 120: 3882–3890., : Involvement of IL-5 in a murine model of allergic pulmonary inflammation: prophylactic and therapeutic effect of an anti-IL-5 antibody.
Am J Respir Cell Mol Biol 1995; 13: 360–365., : Effects of an antibody to interleukin-5 in a monkey model of asthma.
Am J Respir Crit Care Med 1995; 152: 467–472., : Targeted deletion of a high-affinity GATA-binding site in the GATA-1 promoter leads to selective loss of the eosinophil lineage in vivo.
J Exp Med 2002; 195: 1387–1395., : Long-term safety of mepolizumab for the treatment of hypereosinophilic syndromes.
J Allergy Clin Immunol 2013; 131: 461–467.ClinicalTrials.org : A safety extension study with benralizumab for asthmatic adults on inhaled corticosteroid plus long-acting β2 agonist (MELTEMI); https://clinicaltrials.gov/ct2/show/NCT02808819; letzter Zugriff: 19.06.2018.ClinicalTrials.org : A study to evaluate the onset of effect and time course of change in lung function with benralizumab in severe, uncontrolled asthma patients with eosinophilic inflammation (SOLANA). https://clinicaltrials.gov/ct2/show/NCT02869438; letzter Zugriff: 25.10.2018.ClinicalTrials.org : A study of the safety and effectiveness of benralizumab to treat patients with severe uncontrolled asthma (ANDHI). https://clinicaltrials.gov/ct2/show/NCT03170271; letzter Zugriff: 25.10.2018.ClinicalTrials.org . Study to evaluate efficacy and safety of benralizumab in reducing oral corticosteroid use in adult patients with severe asthma (PONENTE); https://clinicaltrials.gov/ct2/show/NCT03557307; letzter Zugriff: 25.10.2018.