Vorgeburtlicher Androgeneinfluss auf süchtiges Verhalten in der Adoleszenz
Abstract
Zusammenfassung.Hintergrund: Im Vergleich zu Frauen konsumieren Männer häufiger Alkohol, Tabak sowie illegale Drogen und sind anfälliger für pathologisches Glücksspiel und süchtiges Internetspielen. Die genannten Geschlechtsunterschiede deuten sich bereits im Adoleszentenalter an. Entsprechendes Konsumverhalten steht mit externalisierenden Auffälligkeiten der Jugendlichen in Zusammenhang. Neben sozialen Einflussfaktoren spielen biologische Faktoren eine zentrale Rolle für die Entstehung dieser Geschlechtsunterschiede. Bereits pränatal beeinflussen Androgene und Östrogene die Entwicklung des Gehirns mit bis ins Erwachsenenalter anhaltenden funktionellen und strukturellen Effekten. Intrauterine Sexualhormonexposition ist mit mütterlichen Risikofaktoren wie Stress und Substanzkonsum assoziiert. Ziel: Diese narrative Übersichtsarbeit diskutiert, welche Bedeutung vorgeburtlicher Androgeneinfluss im Mutterleib für die Entwicklung von süchtigem Verhalten und Selbstregulation im späteren Leben haben könnte. Zu diesem Thema wurden in den letzten Jahren tierexperimentelle Untersuchungen mit direkter Modulation pränataler Androgenisierung und klinische assoziative Studien basierend auf Biomarkern wie dem Zeige-/Ringfingerlängenverhältnis (2D:4D) durchgeführt. Ergebnis: Die aktuelle Studienlage lässt vermuten, dass eine verstärkte Androgenisierung des Gehirns während der intrauterinen Entwicklung das Risiko für süchtiges Verhalten und Selbstregulationsdefizite im späteren Leben erhöht. Abschließend werden Präventionsmöglichkeiten in der Schwangerschaft basierend auf diesem Modell diskutiert und ein kurzer Einblick in die Maternal Health and Infant Development in the Follow-up after Pregnancy and a Mindfulness Intervention Studie gegeben. Diese ist ein Teilprojekt des IMAC-Mind Forschungsverbundes zur Verbesserung der psychischen Gesundheit und zur Verringerung der Suchtgefahr im Kindes- und Jugendalter durch Achtsamkeit.
Abstract.Background: Men consume alcohol, tobacco, and illicit drugs more often than women, and they are more prone to pathological gambling and addictive internet gaming. These sex differences are already found during adolescence. The consumption patterns are related to externalizing behavior. In addition to social influences, biological factors play a central role in the development of these differences between men and women. Prenatal exposure to androgens and estrogens shape the brain development with functional and structural effects that persist into adulthood. Intrauterine sex hormone exposure is related to maternal risk factors such as stress and substance use. Aim: In this narrative review, we discuss the potential impact of prenatal androgen exposure in the womb on the development of addictive behaviors and self-regulation in later life. In recent years, this issue has been addressed by animal experiments with direct modulation of prenatal androgenization and clinical association studies based on biomarkers such as the second-to-fourth finger lengths ratio (2D:4D). Results: The available body of literature suggests that reinforced brain androgenization during the intrauterine development increases the risk for addictive behaviors and deficits in self-regulation capacity in later life. Finally, we also discuss prevention strategies during pregnancy targeting this model and refer to the Maternal Health and Infant Development in the Follow-up after Pregnancy and a Mindfulness Intervention study. This investigation is a subproject of the IMAC-Mind research collaborative project to improve mental health and reduce addiction risk in childhood and adolescence through mindfulness.
Zusammenfassung des Teilprojekts 3 im IMAC-Mind Verbund: Während der Schwangerschaft beeinflussen Umweltfaktoren nicht nur die werdende Mutter, sondern auch die Entwicklung des ungeborenen Kindes mit anhaltenden Effekten für die psychische Gesundheit. Humane und tierexperimentelle Studien lassen vermuten, dass pränatale Exposition gegenüber Androgenen eine Rolle für Selbstregulation und süchtiges Verhalten im späteren Leben spielt. Mütterlicher Stress, Alkohol- und Tabakkonsum sind wahrscheinlich mit pränataler Hyperandrogenisierung des Kindes assoziiert. Unklar ist jedoch, ob Interventionen zur Reduktion von Stress und Substanzkonsum der Mütter während der Schwangerschaft die pränatale Androgenexposition des ungeborenen Kindes reduzieren und die kindliche Selbstregulation verbessern können. In der monozentrischen, prospektiven, kontrollierten und untersucherverblindeten Maternal Health and Infant Development in the Follow-up after Pregnancy and a Mindfulness Intervention Studie soll primär überprüft werden, ob eine achtsamkeitsbasierte und kognitiv-verhaltenstherapeutisch orientierte psychotherapeutische und in wesentlichen Teilen App-basierte Intervention bei schwangeren Frauen das Zeige-/Ringfingerlängenverhältnis (2D:4D; Biomarker für pränatale Androgenexposition) und die Selbstregulationsfähigkeit beim 1-jährigen Kind beeinflusst. Diese Studie schafft die Basis zur Etablierung neuer App-basierter Präventionsstrategien während der Schwangerschaft. Sie ist ein Teilprojekt des IMAC-Mind Forschungsverbundes zur Verbesserung der psychischen Gesundheit und zur Verringerung der Suchtgefahr im Kindes- und Jugendalter durch Achtsamkeit.
Einleitung
Geschlechtsunterschiede bei süchtigem Verhalten
Substanzkonsum, süchtiges Verhalten und Suchterkrankungen zeigen im Erwachsenenalter deutliche Geschlechtsunterschiede. Der epidemiologische Suchtsurvey 2015 zum Substanzkonsum in der deutschen Allgemeinbevölkerung (Gomes de Matos, Atzendorf, Kraus & Piontek, 2016) berichtet, dass Männer im Vergleich zu Frauen häufiger Tabak rauchen (Konsum in den letzten 30 Tagen: 31,2 % vs. 26,1 %) und Alkohol trinken (Konsum in den letzten 30 Tagen: 77,1 % vs. 67,8 %). Männer berichten im Geschlechtsvergleich auch häufiger episodisches Rauschtrinken (Konsummuster in den letzten 30 Tagen: 46,5 % vs. 21,6 %) und Konsum von illegalen Drogen (Konsum in den letzten 12 Monaten: z. B. Cannabis 7,4 % vs. 4,9 %). Männer zeigen zudem häufiger süchtiges Internetspielen (1,8 % vs. 0,7 %) (Bouna-Pyrrou et al., 2018; Bouna-Pyrrou, Mühle, Kornhuber & Lenz, 2015) und pathologisches Glücksspiel (Erbas & Buchner, 2012). Zu erwähnen ist jedoch auch, dass Frauen im Vergleich zu Männern häufiger Schlaf- und Beruhigungsmittel nutzen (Einnahme in den letzten 7 Tagen: 6,7 % vs. 3,7 %) (Gomes de Matos, Atzendorf, Kraus & Piontek, 2016) und häufiger süchtige Nutzung sozialer Netzwerke (2,3 % vs. 1,1 %) (Bouna-Pyrrou et al., 2018, 2015) und Kaufsucht (Müller, Trotzke & Steins-Löber, 2019) entwickeln.
Neben den Prävalenzen unterscheiden sich die Geschlechter auch in den Erscheinungsformen süchtigen Verhaltens. Für Alkoholkonsum ist beispielweise zu beobachten, dass Männer im Vergleich zu Frauen früher beginnen, Alkohol zu trinken, und häufiger höherprozentige Getränke zu sich nehmen, einen weniger kontrollierten Trinkstil zeigen, auch häufiger unter Alkoholeinfluss Auto fahren und bei Bestehen einer Alkoholabhängigkeit stärkere Entzugssymptome und häufiger Entzugsanfälle entwickeln. Frauen hingegen konsumieren Alkohol eher zuhause und leiden häufiger unter Begleiterkrankungen (Erol & Karpyak, 2015; Wilsnack, Wilsnack, Gmel & Kantor, 2018). Unter alkoholabhängigen Patienten berichten Männer häufiger als Frauen, dass sie vor Erkrankungsbeginn Alkohol zur Erleichterung sozialer Kontakte konsumiert haben, während Frauen häufiger als Männer angeben, Alkohol wegen Stress, Depression und Angst getrunken zu haben (Müller, Mühle, Kornhuber & Lenz, 2021). Dazu passend ist sozialer Druck ein stärkerer Risikofaktor für Rückfälle bei Männern und negative Emotionen bei Frauen (Erol & Karpyak, 2015; Wilsnack et al., 2018).
Bereits im Jugend- und Adoleszentenalter lassen sich Ansätze für diese Geschlechtsunterschiede finden, die sich früh in der Fähigkeit zur Selbstregulation und später im Konsumverhalten zeigen (Gallimberti et al., 2015; Lampert, Kuntz & KiGGS Study Group, 2014; Pitkänen, Lyyra & Pulkkinen, 2005; van Tetering, van der Laan, de Kogel, de Groot & Jolles, 2020; WHO, 2018; Zeiher, Lange, Starker, Lampert & Kuntz, 2018). Externalisierendes Verhalten steht dabei mit Konsum bei Jugendlichen in Zusammenhang (Colman et al., 2009; Haller et al., 2016; Heradstveit et al., 2018; Pedersen et al., 2018).
Die Ursachen für die genannten Geschlechtsunterschiede sind vielfältig. Eine wichtige Rolle im Bereich sozialer Determinanten spielen Geschlechtsnormen. Aber auch biologische Faktoren erklären, wieso sich Männer anders als Frauen verhalten. Androgene und Östrogene beeinflussen direkt das Verhalten von Männern und Frauen (= „aktivierende“ Effekte). Tierexperimente belegen beispielsweise, dass die Gabe von Sexualhormonen den Alkoholkonsum verändert (für eine Übersicht siehe Lenz et al., 2012). Zusätzlich beeinflussen Sexualhormone aber auch während der vorgeburtlichen Phase im Mutterleib die Hirnentwicklung mit lebenslang anhaltenden Effekten auf Körperwachstum, Erleben und Verhalten (= „organisierende“ Effekte).
Ziele
Die vorliegende narrative Übersichtsarbeit geht der Frage nach, inwieweit pränatale Androgenexposition mit der Entwicklung süchtigen Verhaltens in der Adoleszenz zusammenhängt, welche Biomarker diesen Einfluss messen können und was die aufgezeigten Assoziationen für die klinische Praxis bedeuten. Vor diesem Hintergrund wird im Rahmen des Teilprojektes 3 (TP3: Maternal Health and Infant Development in the Follow-up after Pregnancy and a Mindfulness Intervention [MINDFUL/PMI]; Deutsches Register Klinischer Studien: DRKS00014920) (Lenz et al., 2018b) des IMAC-Mind Verbunds (Improving Mental Health and Reducing Addiction in Childhood and Adolescence through Mindfulness: Mechanisms, Prevention and Treatment, https://www.imac-mind.de/) der Frage nachgegangen, ob ein App-basiertes achtsamkeitsbasiertes und kognitiv-verhaltenstherapeutisch orientiertes Programm zur Verminderung von Stress, Alkohol- und Tabakkonsum bei schwangeren Frauen die mit Biomarkern gemessene Androgenlast beim ungeborenen Kind reduzieren kann. Außerdem soll der Effekt des Programms auf die kindliche Selbstregulation, als temperamentsorientierter Vorläufer von suchtassoziierten Impulskontrollstörungen, im ersten Lebensjahr erforscht werden.
Methodik
In dieser Übersichtsarbeit wird eine Auswahl von präklinischen und klinischen Studien präsentiert, die die Autoren aufgrund ihrer wissenschaftlichen Tätigkeit im Forschungsfeld als relevant zum Verständnis der beschriebenen Zusammenhänge einschätzen. Es handelt sich damit um eine narrative Übersichtsarbeit. Eine systematische Literaturrecherche wurde für diesen Artikel nicht durchgeführt. Die Auswahl der Literatur erfolgte subjektiv durch die Autoren.
Ergebnisse
Im Folgenden werden Studien zum vorgeburtlichen Androgeneinfluss auf süchtiges Verhalten dargestellt. Dabei werden tierexperimentelle und klinisch assoziative Untersuchungen basierend auf dem Zeige-/Ringfingerlängenverhältnis (2D:4D) sowie weiteren Biomarkern zur Erfassung pränataler Androgenexposition dargestellt und diskutiert.
Vorgeburtlicher Androgeneinfluss auf süchtiges Verhalten
Bereits seit langem ist bekannt, dass intrauterine Exposition gegenüber Sexualhormonen zu anhaltenden Neuroadaptationen mit Effekten auf Hirnfunktion und Verhalten führt (Phoenix, Goy, Gerall & Young, 1959). Neben der vorgeburtlichen Phase stellt die Pubertät ein weiteres Fenster für diese organisierenden Effekte dar (Schulz, Molenda-Figueira & Sisk, 2009). Androgene fördern in dieser frühen Phase Hirnmaskulinisierung bei beiden Geschlechtern und bedingen damit innerhalb des Geschlechts stärkere „Männlichkeit“ – natürlich ohne dadurch das genetisch determinierte Geschlecht zu verändern (Lenz et al., 2012, 2019). Dies wirft die Frage auf, ob vorgeburtliche Androgenexposition eine Rolle bei der Entstehung und dem Verlauf von Substanzkonsum und süchtigem Verhalten spielt. Eine solche Funktion hätte präventive Implikationen, da Studien andeuten, dass mütterliche Risikofaktoren wie Stress und Substanzkonsum während der Schwangerschaft mit der kindlichen Androgenexposition zusammenhängen (Lenz et al., 2017; Lilley, Laaksonen, Huitu & Helle, 2010; Rizwan, Manning & Brabin, 2007).
Im Tiermodell konnte gezeigt werden, dass pränatale Testosteronexposition bei weiblichen Schafen die Anzahl dopaminerger Neurone im ventralen tegmentalen Areal, einem für Sucht relevanten Hirnareal, erhöht und dieser Effekt noch im ausgewachsenen Tier nachweisbar ist (Brown et al., 2015). Außerdem führt eine pränatale Behandlung mit Testosteron zur Erhöhung von Dopaminrezeptoren im Nucleus accumbens von adulten männlichen und weiblichen Ratten (Elgueta-Reyes, Martinez-Pinto, Renard & Sotomayor-Zárate, 2021). Neben diesen zellulären Effekten reduziert die intrauterine Blockade des Androgenrezeptors mit Flutamid Alkoholtrinken bei adulten männlichen Mäusen, und die Exposition gegenüber Dihydrotestosteron verstärkt Alkoholaufnahme bei weiblichen Mäusen. Dies geht mit Veränderungen der zerebralen Genexpression einher, für die auch eine Bedeutung bei Suchterkrankungen diskutiert wird (Huber et al., 2018).
Während im Tiermodell die Effekte pränataler Sexualhormonmodulation auf adoleszentes und adultes Verhalten experimentell untersucht werden können, sind solche Studien beim Menschen aus ethischen Gründen nicht möglich. Daneben sind assoziative Studien aufgrund des langen Zeitintervalls zwischen intrauterinem Fenster und Adoleszenz ebenfalls erschwert. Die Humanforschung nutzt daher Biomarker, die im späteren Lebensalter gemessen werden können und deren Entwicklung intrauterin durch Androgene bestimmt wird.
Zeige-/Ringfingerlängenverhältnis (2D:4D)
Der am häufigsten angewandte Biomarker ist 2D:4D (Abbildung 1). Sexualhormone beeinflussen das frühe Wachstum der Finger unterschiedlich. Männer entwickeln daher ein kleineres 2D:4D als Frauen (Hönekopp & Watson, 2010). 2D:4D ist leicht zugänglich und kann einfach mit einem Messschieber oder via Handscan ermittelt werden. Präklinische und klinische Daten lassen vermuten, dass ein kleines 2D:4D höhere intrauterine Androgenexposition und ein hohes 2D:4D geringere intrauterine Androgenexposition anzeigen (Manning, Kilduff, Cook, Crewther & Fink, 2014; Talarovičová, Kršková & Blažeková, 2009). So erhöht die intrauterine Blockade des Androgenrezeptors mit Flutamid bei männlichen Mäusen anhaltend 2D:4D, und die intrauterine Exposition von weiblichen Mäusen mit Dihydrotestosteron erniedrigt das 2D:4D (Zheng & Cohn, 2011). Das fetale Testosteron/Östradiol Verhältnis gemessen in Amniozentesematerial korreliert negativ mit dem kindlichen rechten 2D:4D zwei Jahre nach der Geburt (Lutchmaya, Baron-Cohen, Raggatt, Knickmeyer & Manning, 2004). Frauen mit einem männlichen Zwilling entwickeln ein kleineres 2D:4D als Frauen mit einem weiblichen Zwilling (van Anders, Vernon & Wilbur, 2006; Voracek & Dressler, 2007), was durch einen intrauterinen Androgenaustausch erklärt werden könnte. Diese Ergebnisse stützen den Nutzen von 2D:4D als Biomarker für pränatale Androgenexposition. Wichtig ist außerdem, dass in einer Meta-Analyse 2D:4D nicht mit peripheren Sexualhormonkonzentrationen assoziiert war. Dies unterstreicht, dass 2D:4D Einblicke in organisierende pränatale Sexualhormoneffekte ermöglicht (Hönekopp, Bartholdt, Beier & Liebert, 2007). Hier soll nicht unerwähnt bleiben, dass einige Studien diese Effekte jedoch nicht nachweisen konnten oder relevante Einflussfaktoren wie Ethnizität und Alter vor allem bei Kindern identifiziert haben (Ernsten, Körner, Heil, Richards & Schaal, 2021; Huber, Lenz, Kornhuber & Müller, 2017; Manning, Stewart, Bundred & Trivers, 2004; McIntyre, 2006), was auch den Nutzen, die Validität und die Reliabilität von 2D:4D als einfachen Biomarker für pränatale Androgenexposition in Frage stellt (Swift-Gallant, Johnson, Di Rita & Breedlove, 2020).
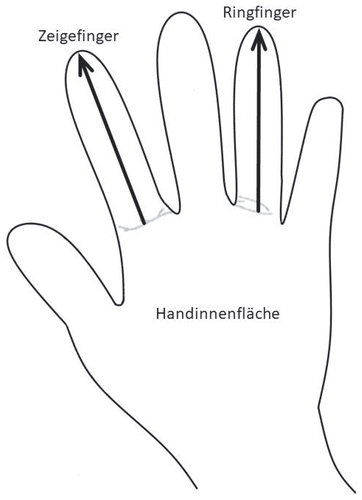
In einer Meta-Analyse (Siegmann, Bouna-Pyrrou, Lenz & Kornhuber, 2019) konnte kleineres 2D:4D bei Personen mit Substanz- und erhöhtem Computergebrauch im Vergleich zu Kontrollen gezeigt werden (Hedge’s g = –0.178). Dies deutet an, dass intrauterine Hyperandrogenisierung einen Risikofaktor für späteren Substanzkonsum und süchtiges Verhalten darstellt. Die Effekte waren stärker in der männlichen Subkohorte (–0.260) und bei den Vergleichen von abhängigen vs. nicht abhängigen Kohorten (gesamt: –0.325; Männer: –0.427). Darüber hinaus konnten Studien zeigen, dass kleineres 2D:4D bei männlichen Patienten mit alkoholbezogener Störung mit höheren Leberwerten im Blut (Transaminasen), stärkeren Entzugssymptomen, mehr stationären Wiederaufnahmen im Follow-up über 1 Jahr und einer höheren Bereitschaft, Geld für alkoholische Getränke auszugeben, assoziiert ist; kleineres 2D:4D steht auch in Zusammenhang mit höherer Erwartung, sich nach Alkoholaufnahme berauscht zu fühlen (Lenz et al., 2017; Lenz, Mühle, Cohort Study on Substanc Use Risk Factors & Kornhuber, 2020). Außerdem korreliert 2D:4D negativ mit der Schwere und Anzahl von Binge Drinking Episoden, auch hier stärker bei Männern als bei Frauen (Lenz, Bouna-Pyrrou, Mühle & Kornhuber, 2018a), sowie pathologischem Videospiel- und Onlinepornographiegebrauch (Buchholz, Mühle, Cohort Study on Substance Use Risk Factors, Kornhuber & Lenz, 2021; Kornhuber et al., 2013). Zusammengefasst deutet dies an, dass intrauterine Hyperandrogenisierung ein relevanter Faktor für süchtiges Verhalten (und weniger für Konsum) bei Männern (und weniger bei Frauen) ist.
Dazu passend haben vielen Studien Assoziationen zwischen kleinerem 2D:4D und möglichen für Sucht prädisponierenden Verhaltensweisen gefunden. Auch diese Befunde sind im Geschlechtsvergleich eher bei Jungen und Männern zu finden. So ist bei Jungen und Männern kleineres 2D:4D assoziiert mit stärkerer Angstreaktivität im Kindesalter (Bergman, Glover, Sarkar, Abbott & O‘Connor, 2010), mehr Verhaltensauffälligkeiten im Grundschulalter (Eichler et al., 2018), häufigeren ADHS Diagnosen im Jugendalter (Martel, Gobrogge, Breedlove & Nigg, 2008) sowie sozialerem Verhalten (Buchholz, Mühle, Cohort Study on Substance Use Risk Factors, Kornhuber & Lenz, 2019) und Aggressivität im Erwachsenenalter (Hönekopp & Watson, 2011).
Pubertätsalter und otoakustische Emissionen
Weitere mögliche Biomarker für pränatale Androgenexposition sind das Alter bei Eintritt in die Pubertät sowie die Stärke der otoakustischen Emissionen. Bei männlichen Ratten führt die pränatale Behandlung mit Testosteron zu einer verspäteten Geschlechtsreife (Dela Cruz & Pereira, 2012). Die Beobachtungen, dass sowohl alkoholabhängige Patienten als auch Personen mit Binge Drinking im Vergleich zu Kontrollprobanden ein höheres Alter bei Pubertätsbeginn berichten (Lenz et al., 2018a, 2017), erhärten daher das Modell, dass intrauterine Hyperandrogenisierung das Risiko für Suchterkrankungen im späteren Leben erhöht. Ebenfalls dazu passend finden sich bei alkoholabhängigen Patienten schwächere otoakustische Emissionen (Lenz et al., 2017), was entsprechend präklinischer Daten auf pränatale Hyperandrogenisierung hinweist (McFadden, 2009).
Diskussion
Zusammenfassung und Forschungslücken
In der Vergangenheit wurden zahlreiche Faktoren identifiziert, die zu einer Vulnerabilität gegenüber Substanzmissbrauch und -abhängigkeit beitragen. Hierzu gehören Umwelteinflüsse (z. B. soziale Normen, Einfluss von Gleichaltrigen, Beziehung zu den Eltern), psychologische Merkmale (z. B. kognitive Fähigkeiten, Persönlichkeitsaspekte) und biologische Faktoren (Conrod & Nikolaou, 2016; Meque, Salom, Betts & Alati, 2019; Raftery et al., 2020). In der vorliegenden Arbeit lag der Fokus auf letztgenannten, die in ihrer Bedeutung im Kanon der weiteren Entstehungsmerkmale zu sehen sind.
Die oben dargestellten Befunde liefern konvergierende Evidenz dafür, dass hohe intrauterine Androgenexposition das Risiko für das Auftreten von süchtigem Verhalten vor allem bei Männern im späteren Leben erhöhen könnte. Es muss hier einschränkend erwähnt werden, dass für diese narrative Übersichtsarbeit keine systematische Literaturrecherche durchgeführt wurde. Es besteht daher das Risiko, dass relevante Arbeiten übersehen wurden und Inhalte selektiv dargestellt sind.
Wir empfehlen folgende Ansatzpunkte, um das Feld weiter voranzubringen: Vor allem sollten die Validität und Reliabilität der in klinischen Untersuchungen genutzten Biomarker in zukünftigen Studien weiter geprüft werden. Günstig wären longitudinale Studien, die die intrauterine Androgenexposition möglichst direkt, z. B. in Amniozentesematerial messen und den Zusammenhang mit prädisponierenden Verhaltensmerkmalen und süchtigem Verhalten im Entwicklungsverlauf bis hin zur Adoleszenz direkt untersuchen. Es ist außerdem wichtig festzuhalten, dass die in Humanstudien gefundenen Zusammenhänge zwischen 2D:4D und süchtigem Verhalten überwiegend kleinere bis mittlere Effektgrößen aufwiesen. Die pränatale Androgenexposition muss daher als ein einzelner Faktor in einem multifaktoriellen Entstehungsmodell für Erlebens- und Verhaltensauffälligkeiten in Kindheit, Jugend und Erwachsenenalter verstanden werden, der nur einen kleinen Teil zur Erklärung der Gesamtvarianz beiträgt. Darüber hinaus sind experimentelle Studien zur Klärung zugrundeliegender biologischer und psychologischer Wirkmechanismen sowie zum Nachweis von Kausalität notwendig. Abschließend ist speziell die Evidenz für das Adoleszentenalter noch gering.
Abgeleitete präventive Ansätze
Es gibt Hinweise darauf, dass Stress und Substanzkonsum der Mutter während der Schwangerschaft das Risiko für süchtiges Verhalten im späteren Leben des Adoleszenten erhöhen könnte und intrauterine Androgenexposition dabei eine Rolle spielen könnte. Testosteron korreliert mit Kortisol im Amniozentesematerial bei Jungen und Mädchen (Sarkar, Bergman, O‘Connor & Glover, 2008). Mütter, die während der Schwangerschaft mehr Stress angeben, haben Kinder mit kleinerem 2D:4D (Lenz et al., 2017). Damit übereinstimmend korreliert höheres Kortikosteron bei trächtigen Wühlmäusen mit kleinerem 2D:4D bei den Nachkommen (Lilley et al., 2010). Neben diesem Effekt mütterlichen Stresses auf kindliche pränatale Androgenexposition beeinflusst Stress auch späteres Konsumverhalten (Campbell, Szumlinski & Kippin, 2009). Auch Rauchen und Alkoholkonsum von schwangeren Frauen wurden mit kleinerem 2D:4D (Lenz et al., 2017; Rizwan et al., 2007) sowie Substanzkonsum und Verhaltensauffälligkeiten (Kandel, Wu & Davies, 1994; Weissman, Warner, Wickramaratne & Kandel, 1999) bei den Nachkommen assoziiert.
Mütterlicher Stress sowie Alkohol- und Tabakkonsum sind modifizierbar und stellen präventive Ansatzpunkte dar. Daher werden derzeit in der monozentrischen, prospektiven, kontrollierten und untersucherverblindeten MINDFUL/PMI Studie, die ein Teilprojekt (Teilprojekt 3, TP3) des IMAC-Mind Verbundes darstellt, die Hypothesen getestet, dass ein 15-wöchiges, achtsamkeitsorientiertes, App-basiertes Programm zur Reduktion von Stress und Verminderung von Alkohol- und Tabakkonsum in der Schwangerschaft das kindliche 2D:4D erhöhen kann sowie die kindliche Selbstregulationsfähigkeit im Alter von einem Jahr verbessern kann (Lenz et al., 2018b).
Fazit
In diesem Artikel wird diskutiert, dass mütterlicher Stress und Substanzkonsum zur intrauterinen Androgenexposition des Kindes beitragen, und dies im weiteren Verlauf das Risiko für süchtiges Verhalten des Kindes in der Adoleszenz beeinflusst. Zur Absicherung dieses Modells besteht noch deutlicher Forschungsbedarf. Nichtsdestotrotz unterstreicht es die Notwendigkeit von Maßnahmen zur Reduktion von Stress und Substanzkonsum in der Schwangerschaft. Werdenden Müttern mit entsprechenden Belastungen sollte passende Unterstützung angeboten werden. Zudem sollten Entstehungsmodelle für psychische Gesundheit und Krankheit verstärkt pränatale Faktoren berücksichtigen, deren genaue Bedeutung allerdings in zukünftigen Forschungsprojekten noch zu entwickeln ist.
Literatur
(2010). In utero cortisol and testosterone exposure and fear reactivity in infancy. Hormones and Behavior, 57, 306–312.
(2018). Cross-sectional and longitudinal evaluation of the social network use disorder and internet gaming disorder criteria. Frontiers in Psychiatry, 9, 692.
(2015). Internet gaming disorder, social network disorder and laterality: handedness relates to pathological use of social networks. Journal of Neural Transmission, 122, 1187–1196.
(2015). Sex differences and effects of prenatal exposure to excess testosterone on ventral tegmental area dopamine neurons in adult sheep. European Journal of Neuroscience, 41, 1157–1166.
(2021). Markers of prenatal androgen exposure correlate with online sexual compulsivity and erectile function in young men. Frontiers in Psychiatry, 12, 517411.
(2019). Lower digit ratio (2D:4D) indicative of excess prenatal androgen is associated with increased sociability and greater social capital. Frontiers in Behavioral Neuroscience, 13, 246.
(2009). Contribution of early environmental stress to alcoholism vulnerability. Alcohol, 43, 547–554.
(2009). Outcomes of conduct problems in adolescence: 40 year follow-up of national cohort. BMJ, 338, a2981.
(2016). Annual Research Review: On the developmental neuropsychology of substance use disorders. Journal of Child Psychology and Psychiatry, 57, 371–394.
(2012). Prenatal testosterone supplementation alters puberty onset, aggressive behavior, and partner preference in adult male rats. Journal of Physiological Sciences, 62, 123–131.
(2018). Digit ratio (2D:4D) and behavioral symptoms in primary-school aged boys. Early Human Development, 119, 1–7.
(2021). Neonatal programming with sex hormones: Effect on expression of dopamine D1 receptor and neurotransmitters release in nucleus accumbens in adult male and female rats. European Journal of Pharmacology, 902, 174118.
(2012). Pathological gambling: prevalence, diagnosis, comorbidity, and intervention in Germany. Deutsches Ärzteblatt International, 109, 173–179.
(2021). Investigating the reliability and sex differences of digit lengths, ratios, and hand measures in infants. Scientific Reports, 11, 10998.
(2015). Sex and gender-related differences in alcohol use and its consequences: Contemporary knowledge and future research considerations. Drug and Alcohol Dependence, 156, 1–13.
(2015). Prevalence of substance use and abuse in late childhood and early adolescence: What are the implications? Preventive Medicine Reports, 2, 862–867.
(2016). Substanzkonsum in der Allgemeinbevölkerung in Deutschland: Ergebnisse des Epidemiologischen Suchtsurveys 2015. SUCHT, 62, 271–281.
(2016). Langzeitfolgen externalisierender Verhaltensauffälligkeiten. Kindheit und Entwicklung, 25, 31–40.
(2020). Addiction Research Consortium: Losing and regaining control over drug intake (ReCoDe)—from trajectories to mechanisms and interventions. Addiction Biology, 25, e12866.
(2018). Prospective associations between childhood externalising and internalising problems and adolescent alcohol and drug use: The Bergen Child Study. Nordisk alkohol- & narkotikatidskrift, 35, 357–371.
(2007). Second to fourth digit length ratio (2D:4D) and adult sex hormone levels: New data and a meta-analytic review. Psychoneuroendocrinology, 32, 313–321.
(2010). Meta-analysis of digit ratio 2D:4D shows greater sex difference in the right hand. American Journal of Human Biology, 22, 619–630.
(2011). Meta-analysis of the relationship between digit-ratio 2D:4D and aggression. Personality and Individual Differences, 51, 381–386.
(2017). Prenatal androgen-receptor activity has organizational morphological effects in mice. PLoS One, 12, e0188752.
(2018). Prenatal androgen receptor activation determines adult alcohol and water drinking in a sex-specific way. Addiction Biology, 23, 904–920.
(1994). Maternal smoking during pregnancy and smoking by adolescent daughters. American Journal of Public Health, 84, 1407–1413.
(2013). Low 2D:4D values are associated with video game addiction. PLoS One, 8, e79539.
(2014). Tabak- und Alkoholkonsum bei 11- bis 17-jährigen Jugendlichen: Ergebnisse der KiGGS-Studie – Erste Folgebefragung (KiGGS Welle 1). Bundesgesundheitsblatt - Gesundheitsforschung - Gesundheitsschutz, 57, 830–839.
(2018a). Low digit ratio (2D:4D) and late pubertal onset indicate prenatal hyperandrogenziation in alcohol binge drinking. Progress in Neuro-Psychopharmacology & Biological Psychiatry, 86, 370–378.
(2018b). Mindfulness-based stress reduction in pregnancy: an app-based programme to improve the health of mothers and children (MINDFUL/PMI study). Geburtshilfe und Frauenheilkunde, 78, 1283–1291.
(2017). Prenatal and adult androgen activities in alcohol dependence. Acta Psychiatrica Scandinavica, 136, 96–107.
(2020). Lower digit ratio (2D:4D) in alcohol dependence: Confirmation and exploratory analysis in a population-based study of young men. Addiction Biology, 25, e12815.
(2012). Sex hormone activity in alcohol addiction: Integrating organizational and activational effects. Progress in Neurobiology, 96, 136–163.
(2019). The androgen model of suicide completion. Progress in Neurobiology, 172, 84–103.
(2010). Maternal corticosterone but not testosterone level is associated with the ratio of second-to-fourth digit length (2D:4D) in field vole offspring (Microtus agrestis). Physiology & Behavior , 99, 433–437.
(2004). 2nd to 4th digit ratios, fetal testosterone and estradiol. Early Human Development, 77, 23–28.
(2014). Digit ratio (2D:4D): a biomarker for prenatal sex steroids and adult sex steroids in challenge situations. Frontiers in Endocrinology, 5, 9.
(2004). Sex and ethnic differences in 2nd to 4th digit ratio of children. Early Human Development, 80, 161–168.
(2008). Masculinized finger-length ratios of boys, but not girls, are associated with attention-deficit/hyperactivity disorder. Behavioral Neuroscience, 122, 273–281.
(2009). Masculinization of the mammalian cochlea. Hearing Research, 252, 37–48.
(2006). The use of digit ratios as markers for perinatal androgen action. Reproductive Biology and Endocrinology, 4, 10.
(2019). Predictors of alcohol use disorders among young adults: A systematic review of longitudinal studies. Alcohol Alcohol, 54, 310–324.
(2019). Kaufsucht im Internet. Suchttherapie, 20 (4), 192–197.
(2021). Sex-dependent alcohol instrumentalization goals in non-addicted alcohol consumers versus patients with alcohol use disorder: Longitudinal change and outcome prediction. Alcoholism: Clinical and Experimental Research, 45, 577–586.
(2018). Externalizing behavior problems are related to substance use in adolescents across six samples from Nordic countries. European Child & Adolescent Psychiatry, 27, 1551–1561.
(1959). Organizing action of prenatally administered testosterone propionate on the tissues mediating mating behavior in the female guinea pig. Endocrinology, 65, 369–382.
(2005). Age of onset of drinking and the use of alcohol in adulthood: a follow-up study from age 8–42 for females and males. Addiction, 100, 652–661.
(2020). Insight in substance use disorder: A systematic review of the literature. Addictive Behaviors, 111, 106549.
(2007). Maternal smoking during pregnancy and possible effects of in utero testosterone: Evidence from the 2D:4D finger length ratio. Early Human Development, 83, 87–90.
(2008). Maternal antenatal anxiety and amniotic fluid cortisol and testosterone: possible implications for foetal programming. Journal of Neuroendocrinology, 20, 489–496.
(2009). Back to the future: The organizational-activational hypothesis adapted to puberty and adolescence. Hormones and Behavior, 55, 597–604.
(2019). Digit ratio (2D:4D) in relation to substance and computer use: a meta-analysis. Journal of Neural Transmission, 126, 623–636.
(2020). Through a glass, darkly: Human digit ratios reflect prenatal androgens, imperfectly. Hormones and Behavior, 120, 104686.
(2009). Testosterone enhancement during pregnancy influences the 2D:4D ratio and open field motor activity of rat siblings in adulthood. Hormones and Behavior, 55, 235–239.
(2006). Finger-length ratios show evidence of prenatal hormone-transfer between opposite-sex twins. Hormones and Behavior, 49, 315–319.
(2020). Sex differences in self-regulation in early, middle and late adolescence: A large-scale cross-sectional study. PLoS One, 15, e0227607.
(2007). Digit ratio (2D:4D) in twins: heritability estimates and evidence for a masculinized trait expression in women from opposite-sex pairs. Psychological Reports, 100, 115–126.
(1999). Maternal smoking during pregnancy and psychopathology in offspring followed to adulthood. Journal of the American Academy of Child and Adolescent Psychiatry, 38, 892–899.
WHO . (2018). Global status report on alcohol and health 2018. Available from http://www.who.int/substance_abuse/publications/global_alcohol_report/en/(2018). Gender differences in binge drinking. Alcohol Research, 39, 57–76.
(2018). Tabak- und Alkoholkonsum bei 11- bis 17-Jährigen in Deutschland – Querschnittergebnisse aus KiGGS Welle 2 und Trends. Journal of Health Monitoring, 3 (2), 23–44.
(2011). Developmental basis of sexually dimorphic digit ratios. Proceedings of the National Academy of Sciences of the United States of America, 108, 16289–16294.