Microangiopathie cérébrale et troubles cognitifs
Abstract
Zusammenfassung. Zerebrale Mikroangiopathien umfassen eine Gruppe neuropathologischer Prozesse, die die kleinen Perforationsarterien, Arteriolen und Kapillaren beeinflussen. Neuroimaging-Merkmale der Einengung der kleinen Koronararterienäste (Small Vessel Disease) sind ischämische und hämorrhagische Marker: jüngster kleiner subkortikaler Infarkt, Lakune vermuteten vaskulären Ursprungs, Hyperintensität der weissen Masse, perivaskuläre Räume, zerebrale Mikroblutungen, Hirnatrophie, kortikale oberflächliche Siderose und akute subarachnoidale Blutungen. Diese Läsionen gelten als der Hauptrisikofaktor der vaskulären kognitiven Störungen. Die zerebrale Mikroangiopathie wird typischerweise in zwei Hauptformen kategorisiert: die nicht-amyloide Angiopathie, die auch als «hypertensive Arteriopathie» bezeichnet wird, die oft mit fortgeschrittenem Alter und vaskulären Risikofaktoren und der zerebralen Amyloidangiopathie zusammenhängt. Die zerebrale Amyloidangiopathie ist klinisch charakterisiert durch kognitive Beeinträchtigungen, intrazerebrale Blutungen und durch transiente Episoden fokal-neurologischer Defizite aufgrund von Subarachnoidalblutungen.
Abstract. Cerebral small vessel disease encompasses a group of neuropathological processes affecting the small perforating arteries, arterioles and capillaries. Neuroimaging features of small vessel disease are ischemic and hemorrhagic markers: recent small subcortical infarct, lacune of presumed vascular origin, white matter hyperintensity, perivascular spaces, cerebral microbleeds, brain atrophy, cortical superficial siderosis and acute convexity subarachnoid hemorrhage. These lesions are considered the main risk factor of vascular cognitive disorders. Cerebral small vessel disease is typically categorized in two main forms: the non-amyloid angiopathy, also called «hypertensive arteriopathy», which is often related to advanced age and vascular risk factors, and the cerebral amyloid angiopathy. Cerebral amyloid angiopathy is clinically characterized by cognitive impairment, intra-cerebral hemorrhage and amyloid spell due to sub-arachnoid hemorrhage.
Résumé. La microangiopathie cérébrale correspond à l’atteinte des petits vaisseaux cérébraux. Les marqueurs de la microangiopathie en imagerie cérébrale sont de nature ischémique et hémorragique: petits infarctus sous-corticaux récents, lacune d’origine vasculaire présumée, hypersignaux de substance blanche, espaces péri-vasculaires, microsaignements cérébraux, atrophie cérébrale, sidérose superficielle corticale et hémorragies sous-arachnoïdiennes focales. Ces lésions sont considérées actuellement comme les principaux facteurs des troubles cognitifs d’origine vasculaire, d’autant plus qu’il semblerait exister un continuum entre microangiopathie cérébrale et maladie d’Alzheimer. La microangiopathie regroupe deux entités: l’angiopathie non amyloïde, favorisée par l’âge avancé et les facteurs de risque vasculaire, et l’angiopathie amyloïde, dont les principales caractéristiques cliniques, outre les troubles cognitifs, sont la survenue de déficits neurologiques itératifs stéréotypés et d’hématomes intra-parenchymateux lobaires.
Introduction
La microangiopathie cérébrale est un terme générique encore mal défini, qui désigne un ensemble de lésions cérébrales ischémiques et hémorragiques pouvant être détectées en Imagerie par Résonance Magnétique (IRM). Souvent banalisées jusqu’alors car méconnues, ces lésions sont considérées actuellement comme les principaux facteurs des troubles cognitifs d’origine vasculaire. On distingue deux entités: l’angiopathie non amyloïde et l’angiopathie amyloïde, ce qui laisse suspecter des liens étroits entre lésions cérébrales vasculaires et lésions amyloïdes de la maladie d’Alzheimer.
Dans cet article, nous aborderons uniquement la microangiopathie acquise, les lésions d’origine génétique (CADASIL, angiopathie amyloïde cérébrale familiale) étant exclues.
Définition
La microangiopathie se définit par l’atteinte des petits vaisseaux cérébraux (small vessel disease) [1, 2]. Les petits vaisseaux correspondent à tous vaisseaux ayant un diamètre compris entre 5 µm et 2 mm, situés dans le parenchyme cérébral ou les espaces sous-arachnoïdiens (vaisseaux leptoméningés): petites artères, artérioles, capillaires, veinules, petites veines. Les petites artères ou artérioles impliquées peuvent être des branches superficielles irriguant le cortex cérébral, ou des branches profondes à destinée des noyaux gris centraux, des thalami ou du tronc cérébral. Dans tous les cas, ce sont de petites artères ou artérioles terminales.
Marqueurs de la microangiopathie cérébrale en neuroimagerie
En 2013 a été publié un consensus d’experts, STRIVE (standards for reporting vascular changes on neuroimaging) [1], définissant les lésions de microangiopathie cérébrale en IRM. Ces lésions sont, pour la plupart, d’ordre ischémique ou hémorragique. On distingue les petits infarctus sous-corticaux récents, les lacunes d’origine vasculaire présumée, les hypersignaux de substance blanche, les espaces péri-vasculaires, les microsaignements cérébraux (microbleeds), l’atrophie cérébrale, la sidérose superficielle corticale et les hémorragies sous-arachnoïdiennes focales (Fig. 1).
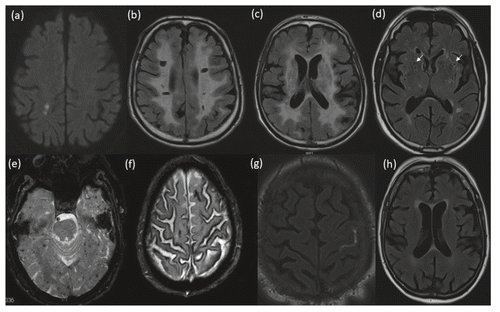
Les petits infarctus sous-corticaux récents correspondent aux manifestations aiguës de la microangiopathie par atteinte des artérioles perforantes. La plupart de ces infarctus deviendront des lacunes, mais certains peuvent ne plus être visibles en imagerie cérébrale avec le temps. D’après le registre dijonnais des AVC [3], ces lésions aiguës correspondent à 28 % des infarctus cérébraux symptomatiques. Certaines de ces lésions sont asymptomatiques et de découverte fortuite tandis que d’autres peuvent ne pas être visualisées par les techniques d’imagerie conventionnelle, alors même que le patient présente un syndrome lacunaire clinique (30 % des cas en IRM, 50 % des cas en tomodensitométrie) [4]. Dans ce cas, ce sont les nouvelles techniques d’imagerie, telles que l’IRM 7 teslas, uniquement disponibles dans les laboratoires de recherche, qui permettraient d’objectiver des lésions ischémiques de petite taille, corticales ou sous-corticales [5].
La nouvelle classification distingue ces lésions des lacunes d’origine vasculaire présumée, décrites comme des lésions rondes ou ovalaires, d’allure liquidienne (signal identique à celui du liquide céphalorachidien en IRM), de 3 à 15 mm de diamètre, correspondant à des séquelles d’infarctus sous-corticaux ou d’hémorragie dans le territoire d’une artériole perforante.
Les hypersignaux de substance blanche d’origine vasculaire présumée correspondent à des hyperintensités sous-corticales T2 FLAIR en IRM, d’étendue variable, bilatérale et symétrique et dont la physiopathologie reste complexe et méconnue. Ils sont considérés comme la source principale de troubles cognitifs.
Les espaces péri-vasculaires correspondent à des espaces liquidiens situés autour des vaisseaux qui traversent la substance blanche ou la substance grise. Leur signal IRM est le même que celui du LCR. Ils apparaissent linéaires ou ronds/ovoïdes avec un diamètre de moins de 3 mm, en fonction de la tranche de section de la coupe d’IRM.
Les microsaignements cérébraux sont des lésions rondes ou ovalaires de 2 à 5 mm de diamètre apparaissant en hypo-intensité dans les séquences T2* de l’IRM. Ils correspondent à une extravasation de sang dans le tissu périvasculaire. Leur localisation peut être lobaire ou profonde, et ils peuvent être associés à des hémorragies intra-parenchymateuses.
La sidérose corticale superficielle et les hémorragies méningées focales apparaissent également en hypo-intensité sur les séquences T2*, au niveau des espaces sous-arachnoïdiens du cortex cérébral.
L’atrophie cérébrale correspond à une réduction du volume cérébral, en l’absence de lésion cérébrale macroscopique. Elle peut être globale ou focale (corps calleux, ganglions de la base …).
Présentation clinique de la microangiopathie
Les manifestations cliniques de la microangiopathie sont variées. Les plus connues correspondent aux déficits neurologiques aigus et focaux, d’origine ischémique ou hémorragique, transitoires ou constitués. Les syndromes lacunaires en constituent les manifestations ischémiques les plus classiques: déficit moteur pur, déficit sensitif pur, hémiparésie ataxiante, dysarthrie – main malhabile, déficit sensitivo-moteur [6]. Des déficits neurologiques transitoires récidivants et stéréotypés doivent faire évoquer une hémorragie méningée focale symptomatique [7].
La microangiopathie serait également responsable de près de 45 % des troubles cognitifs majeurs [8]. Les lésions cérébrales les plus pourvoyeuses de troubles cognitifs sont les hypersignaux de substance blanche, les lacunes et les microhémorragies. L’étude européenne multicentrique LADIS study [], évaluant des patients de 65 à 84 ans, a permis d’apporter des arguments en ce sens. En effet, les patients qui avaient des hypersignaux de substance blanche présentaient des troubles cognitifs à type de troubles dysexécutifs, altération de la vitesse de traitement de l’information, troubles attentionnels, en dénomination et des praxies visuo-constructives [11]. En outre, les patients qui avaient la perte d’autonomie la plus importante étaient ceux dont les hypersignaux de substance blanche étaient les plus nombreux et confluents. La présence de lésions lacunaires était également un facteur indépendant de déclin cognitif, surtout celles présentes au niveau de localisations cérébrales stratégiques (thalamus, putamen, pallidum) [12]. En outre, la LADIS study a également souligné une évolution cognitive plus péjorative (dans les domaines de la mémoire, des fonctions exécutives et de la vitesse de traitement de l’information) en cas d’association hypersignaux de substance blanche et atrophie cérébrale temporale interne [13]. Enfin, les microhémorragies cérébrales sont également pourvoyeuses de troubles cognitifs: ralentissement psychomoteur, troubles dysexécutifs, baisse des performances attentionnelles, et déficits aux tests mnésiques en cas de lésions lobaires [14].
D’autres symptômes sont également décrits en lien avec la microangiopathie: troubles de la marche et de l’équilibre pouvant entrainer des chutes, incontinence urinaire, symptômes dépressifs [10].
Catégorisation des différents types de microangiopathie
Les pathologies sporadiques des petits vaisseaux cérébraux peuvent être classées en deux grandes catégories distinctes: l’angiopathie amyloïde et l’angiopathie non amyloïde (Tab. 1).

L’angiopathie non amyloïde, ou angiopathie hypertensive, se caractérise par une altération de la paroi des vaisseaux cérébraux, par amincissement du collagène, rétrécissement de la lumière des vaisseaux, perte progressive des muscles lisses de la média, et parfois dépôts de lipides, mais sans dépôt amyloïde [2, 15]. Elle est favorisée par l’âge avancé et la plupart des facteurs de risque vasculaires, tels l’hypertension artérielle, le diabète sucré, le tabagisme. Elle affecte préférentiellement les artérioles perforantes terminales des noyaux gris centraux et de la substance blanche profonde. Elle peut être responsable de toutes les lésions de microangiopathie préalablement décrites, ischémiques ou hémorragiques. Cliniquement, l’angiopathie non amyloïde est responsable d’une atteinte cognitive sous-corticale [16], caractérisée par des troubles dysexécutifs au premier plan (troubles d’inhibition, de contrôle et d’exécution des tâches) et des troubles mnésiques au second plan (troubles en mémoire épisodique verbale en rappel, avec aide de l’indiçage). Peuvent s’y associer des modifications comportementales (ralentissement, apathie, labilité émotionnelle) et des troubles neurologiques extra-cognitifs (syndrome extra-pyramidal, troubles de la marche, dysarthrie).
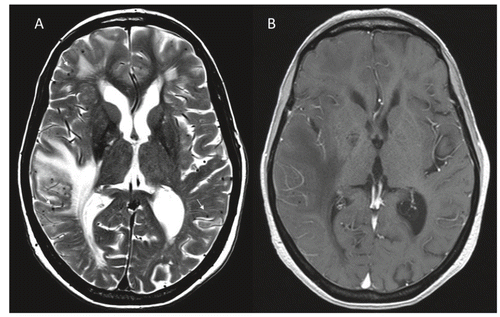
L’angiopathie amyloïde cérébrale [17] est caractérisée par la présence de dépôts de peptides A-béta-amyloïdes (peptides Aβ 1–40 distincts des plaques de la maladie d’Alzheimer constituées de peptides Aβ 1–42) dans la paroi d’artères de petit et de moyen calibre, voire de capillaires ou de veines, au niveau leptoméningé et cérébral. Le siège des dépôts amyloïdes est cortical lobaire et au niveau des espaces méningés, essentiellement en postérieur (lobes pariétaux et occipitaux). Contrairement à l’angiopathie non amyloïde, les régions cérébrales profondes sont épargnées. Le cervelet peut également être le siège de dépôts amyloïdes. Les lésions cérébrales préalablement décrites en imagerie peuvent toutes se rencontrer au cours de l’angiopathie amyloïde. La physiopathologie n’est pas claire, mais les hypothèses les plus récentes évoquent un dysfonctionnement du drainage des peptides amyloïdes par le liquide interstitiel cérébral [18]. Les manifestations cliniques liées à l’angiopathie amyloïde cérébrale sont de trois ordres: hématome lobaire spontané, déficit neurologique transitoire ou amyloid spell, et troubles cognitifs. Le registre dijonnais des AVC [19] a souligné une incidence de 12,4 hématomes intra-parenchymateux pour 100 000 sujets par an entre 1985 et 2008, représentant 9 % des AVC. Parmi ces hémorragies, 49 % étaient des hématomes lobaires. Malgré une incidence constante sur la période étudiée, cette étude a mis en évidence une augmentation de la proportion d’hématomes lobaires. Les déficits neurologiques transitoires liés à l’angiopathie amyloïde correspondent à de multiples épisodes récidivants et stéréotypés durant quelques minutes. Les symptômes peuvent être positifs (paresthésies chéiro-orales, phénomènes visuels, clonies) ou négatifs (déficit moteur ou visuel, troubles du langage) [7]. Ces épisodes neurologiques récidivants sont associés à la présence d’hémorragies méningées focales secondaires à des dépôts amyloïdes leptoméningés. Enfin, l’angiopathie amyloïde est également responsable de troubles cognitifs, par deux mécanismes: une atteinte neurodégénérative liée à la maladie d’Alzheimer d’une part, et une atteinte vasculaire d’autre part. En effet, plus de 80 % des patients ayant une maladie d’Alzheimer présentent des dépôts vasculaires de peptides amyloïdes. En outre, l’existence de dépôts vasculaires amyloïdes est associée à une forme plus grave de maladie d’Alzheimer, avec un déclin cognitif plus sévère [20]. Des critères diagnostiques reposant sur des données cliniques et radiologiques ont été établis (critères de Boston [21] et Boston modifiés [22]) afin de différencier les angiopathies amyloïdes probables et possibles (Tab. 2). L’angiopathie amyloïde peut également parfois survenir de façon aiguë ou sub-aiguë : il s’agit de l’angiopathie amyloïde inflammatoire [23]. Elle se caractérise par une inflammation des artères de petit et moyen calibre (vascularite aiguë). Cette inflammation est périvasculaire ou intramurale, associée à des dépôts de peptides Aβ 1–40. L’âge moyen de survenue est de 65 ans. Elle se caractérise par un tableau d’encéphalopathie aiguë ou sub-aiguë avec troubles cognitifs, troubles du comportement, céphalées, crises comitiales, signes neurologiques focaux et possibles troubles de conscience. L’imagerie cérébrale met en évidence un œdème cérébral asymétrique par atteintes cortico-sous-corticales multifocales (Fig. 2). Des critères diagnostiques d’angiopathie amyloïde inflammatoire ont été définis récemment (Tab. 3) [24].

Continuum entre microangiopathie vasculaire et maladie d’Alzheimer
L’association entre facteurs de risque vasculaires et maladie d’Alzheimer semble bien plus complexe qu’une simple coïncidence due à l’âge des patients. Le rôle exact des facteurs de risque vasculaires dans la physiopathologie de la maladie d’Alzheimer n’est pas connu [25]. Ces facteurs de risque vasculaires pourraient provoquer un dysfonctionnement neuronal via l’athérosclérose, entrainant une hypoperfusion cérébrale. L’hypoperfusion cérébrale, par le biais de la production d’agents oxydants, pourrait augmenter les dépôts amyloïdes par augmentation du clivage de l’APP (Amyloid Precursor Protein) en protéine β-amyloïde, altération du passage de la protéine β-amyloïde à travers la barrière hémato-encéphalique et diminution de la clairance cérébrale de la protéine β-amyloïde. Les dépôts amyloïdes sont connus pour avoir des propriétés neurotoxiques et pro-inflammatoires, ainsi qu’un rôle de vasoconstriction des vaisseaux cérébraux et d’atténuation de la vasodilatation induite par l’acétylcholine. L’accumulation de protéines β-amyloïdes pourrait ainsi entraîner un dysfonctionnement de l’homéostasie entre neurones, cellules gliales et cellules vasculaires cérébrales, et ainsi provoquer à leur tour un défaut de la régulation du flux sanguin cérébral.
Conclusion
La microangiopathie est donc le reflet de l’atteinte des petits vaisseaux cérébraux, pouvant revêtir différents aspects à l’imagerie. Elle est considérée comme le principal facteur de risque de troubles cognitifs et pourrait intervenir dans la physiopathologie de la maladie d’Alzheimer. Comprendre les liens entre microangiopathie et maladie d’Alzheimer constituera une avancée vers une prise en charge plus adaptée.
Messages-clés
- •La microangiopathie cérébrale est considérée actuellement comme le facteur de risque principal des troubles cognitifs d’origine vasculaire.
- •La microangiopathie cérébrale se répartit en deux entités distinctes: l’angiopathie cérébrale non amyloïde, liée à l’âge et aux principaux facteurs de risque vasculaires, et l’angiopathie cérébrale amyloïde.
- •Les trois principales manifestations cliniques de l’angiopathie cérébrale amyloïde sont les hémorragies cérébrales intra-parenchymateuses lobaires, les déficits neurologiques transitoires itératifs et stéréotypés (amyloid spell) et les troubles cognitifs.
- •L’angiopathie cérébrale amyloïde inflammatoire se manifeste par un tableau d’encéphalopathie aiguë ou sub-aiguë.
Abréviations utilisées dans l’article:
APP Amyloid Precursor Protein
AVC Accident Vasculaire Cérébral
CADASIL Cerebral Autosomal Dominant Arteriopathy with Subcortical Infarcts and Leukoencephalopathy
FLAIR Fluid Attenuated Inversion Recovery
IRM Imagerie par Résonance Magnétique
LCR Liquide Céphalo-Rachidien
STRIVE Standards for Reporting Vascular Changes on Neuroimaging
Bibliographie
, : Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration. Lancet Neurol 2013; 12: 822–838.
: The concept of sporadic cerebral small vessel disease: a road map on bey definitions and current concepts. Int J Stroke 2016; 11: 6–18.
, .: Trends in incidence, risk factors and survival in symptomatic lacunar stroke in Dijon, France, from 1989 to 2006: a population based study. Stroke 2008; 39: 1945–1951.
: Prevalence and risk factors of silent brain infarcts in the population-based Rotterdam Scan Study. Stroke 2002; 33: 21–25.
, .: Microbleeds and microinfarcts detection in amyloid angiopathy: a high-resolution MRI-histopathology study. Brain 2016; 139: 3151–3162.
: Lacunes: small, deep cerebral infarcts. Neurology 1964; 15: 774–784.
, .: Transient ischaemic attack mimics revealing focal subarachnoid haemorrhage. Cerebrovasc Dis 2010; 30: 597–601.
, .: Vascular contributions to cognitive impairment and dementia: a statement for healthcare professionals from the American heart association. American stroke association. Stroke 2011; 42: 2672–2713.
, : Impact of age-related cerebral white matter changes on the transition to disability – the LADIS study: rationale, design and methodology. Neuroepidemiology 2005; 24: 51–62.
,
on behalf of the LADIS Study Group : Impact of cerebral white matter changes on functionality in older adults: an overwiew of the LADIS study results and future directions. Geriatr Gerontol Int 2015; 15: 10–16., :
LADIS Study . Differential impact of cerebral white matter changes, diabetes, hypertension and stroke on cognitive performance among non-disabled elderly. The LADIS study. J Neurol Neurosurg Psychiatry 2007; 78: 1325–1330., .: Location of lacunar infarcts correlates with cognition in a sample of non-disabled subjects with age-related white-matter changes: the LADIS study. J Neurol Neurosurg Psychiatry 2009; 80: 478–483.
, : Small vessel disease and gereral cognitive function in nondisabled elderly: the LADIS study. Stroke 2005; 36: 2116–2120.
: Cerebral microbleeds and cognition in cerebrovascular disease: an update. J Neurol Sci 2012; 322: 50–55.
: Cerebral small vessel disease: from pathogenesis and clinical characteristics to therapeutic challenges. Lancet Neurol 2010; 9: 689–701.
: La démence vasculaire: un cadre incertain. Psychol NeuroPsychiatr Vieil 2005; 3: 89–96.
: Sporadic cerebral amyloid angiopathy revisited: recent insights into pathophysiology and clinical spectrum. J Neurol Neurosurg Psychiatry 2012; 83: 124–137.
, : White matter changes in dementia: role of impaired drainage of interstitial fluid. Brain pathol 2015; 25: 63–78.
: Intracerebral haemorrhage profiles are changing: results from the Dijon population based-study. Brain 2013; 136: 658–664.
, .: Cerebral amyloid angiopathy and cognitive function: the HAAS autopsy study. Neurology 2002; 58: 1629–1634.
, : Clinical diagnosis of cerebral amyloid angiopathy: validation of the Boston criteria. Neurology 2001; 56: 537–539.
, : Prevalence of superficial siderosis in patients with cerebral amyloid angiopathy. Neurology 2010; 74: 1346–1350.
, : Cerebral amyloid angiopathy-related inflammation: imaging findings and clinical outcome. Neuroradiology 2014; 56: 283–289.
, : Validation of clinico-radiological criteria for the diagnosis of cerebral amyloid angiopathy-related inflammation. JAMA Neurol 2015; 73: 197–202.
, : Cerebral small vessel disease and Alzheimer’s disease. Clin Interv Aging 2015; 10: 1695–1704.