Das Long-COVID-Syndrom – ein neues Krankheitsbild nach COVID-19-Infekt
Abstract
Zusammenfassung. Langzeitfolgen nach COVID-19 werden in der Literatur zunehmend berichtet. Noch Monate nach dem akuten Infekt leiden einige Betroffene an Atemnot, Müdigkeit und weiteren Beschwerden. Es wurden Einschränkungen der Lunge im Verlauf berichtet, aber auch Folgen am Immunsystem, am Herzen, am Nervensystem, an der Haut und den Nieren werden beschrieben oder vermutet. Diese Übersichtsarbeit soll den praktizierenden Ärzten und Ärztinnen einen kurzen Überblick über das aktuelle Verständnis des Long-COVID-Syndroms aus der Sicht von verschiedenen Fachexpertinnen und -experten geben. In Zukunft werden wir dieses neue Krankheitsbild besser verstehen und behandeln müssen.
Abstract. Long-term consequences are increasingly reported in the current literature after COVID-19 infections. Some patients suffer from persistent pulmonary and extrapulmonary symptoms even months after the acute infection. Pulmonary impairment, but also dysregulation and effects on immune system, cardiovascular system, neurological system, skin and kidney are described or anticipated. This mini review gives a short update to the practitioner about the current knowledge about Long COVID.
Im Artikel verwendete Abkürzungen
ANV Akutes Nierenversagen
ARDS Acute Respiratory Distress Syndrome
CNI Chronische Niereninsuffizienz
COVID-19 Coronavirus-Erkrankung 2019
CRP C-reaktives Protein
Long-COVID-Syndrom Symptome und Organschäden mehrere Wochen nach COVID-19-Infektion (offizielle Definition ausstehend)
MERS Middle East Respiratory Syndrome
MIS-A Multisystemisches inflammatorisches Syndrom bei Erwachsenen (Adults)
MIS-C Multisystemisches inflammatorisches Syndrom bei Kindern (Children)
MS Multiple Sklerose
Post-COVID Syndrome Postakutes inflammatorisches Geschehen (siehe MIS-C und MIS-A)
SARS Severe Acute Respiratory Syndrome
SARS-CoV-2 SARS-Coronavirus Typ 2
Coronavirus-Infektionen sind bereits vor der aktuellen Pandemie mit COVID-19 aufgetreten und haben zu Epidemien oder Pandemien geführt. Die erste schwerwiegende Pandemie wurde durch das Coronavirus des Severe Acute Respiratory Syndrome (SARS-Coronavirus) 2002–2004 ausgelöst. Bis zu einem Drittel der an SARS Erkrankten entwickelte ein akutes Atemversagen im Sinn eines ARDS (Acute Respiratory Distress Syndrome) [1]. Viele der an SARS erkrankten Personen sind aufgrund des schweren Krankheitsverlaufs gestorben. Bei Überlebenden wurde auch noch ein Jahr nach der SARS-Infektion eine Störung der Sauerstoffaufnahme beobachtet [2]. Eine weitere schwerwiegende Coronavirus-Infektion wurde durch das Middle East Respiratory Syndrome (MERS) erstmals im Jahr 2012 verursacht. MERS hat eine höhere Inzidenz für ARDS bei ebenfalls erhöhter Mortalität (36 %). Für SARS und MERS sind Alter und männliches Geschlecht wesentliche Risikofaktoren [3].
Die Coronavirus-Erkrankung 2019 (COVID-19) zeigt ein ähnliches akutes klinisches Erscheinungsbild wie SARS und MERS mit Fieber, Husten und Atemnot, gefolgt von beidseitigen Lungeninfiltraten in der Bildgebung. Es wird durch das SARS-CoV-2-Virus ausgelöst. Bis zu einem Drittel der manifest Erkrankten entwickelt ein ARDS [4], wobei insbesondere ältere Menschen davon betroffen sind [5]. In der Folge eines ARDS sind anhaltende Folgeschäden mit Einschränkungen bis zu fünf Jahre nach der Erkrankung beschrieben worden [6]. COVID-19 befällt initial die Lunge, im Verlauf zeigt die Krankheit ein breites Spektrum klinischer Manifestationen mit Befall von multiplen Organen (Tabelle 1).
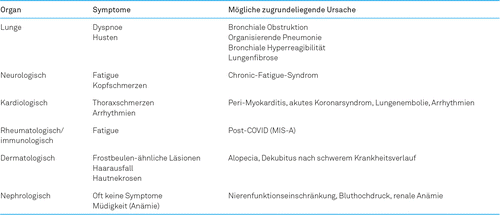
Zu eventuellen Folgeschäden nach COVID-19 fehlt noch die zeitliche Erfahrung, aber zunehmend werden wissenschaftliche Publikationen veröffentlicht, die auf eine solche Problematik hinweisen.
Das sogenannte Long-COVID-Syndrom ist noch nicht genau definiert. Es wurde eine Symptompersistenz von mehr als zwei Monaten nach Infektion zur Definition vorgeschlagen [7]. Der Definition des «National Institute for Health and Care Excellence (NICE)» folgend wird von einem Long-COVID-19-Syndrom ausgegangen, wenn Anzeichen und Symptome, die sich während oder nach einer mit COVID-19 konsistenten Infektion entwickeln, länger als 8–12 Wochen anhalten und nicht durch eine alternative Diagnose erklärt werden können [8, 9]. Die Betroffenen präsentieren sich mit einem breiten Spektrum an pulmonalen und extrapulmonalen Beschwerden, die im Folgenden dargestellt werden. Die Therapiemöglichkeiten sind noch unklar. Es ist auch abzuwarten, welchen Effekt die neuen Impfstoffe auf Long-COVID-Symptome haben werden.
Folgeschäden in der Lunge
Zwei oder mehr Monate nach dem akuten COVID-19-Infekt berichten Betroffene noch über respiratorische Symptome wie Atemnot und Husten neben weiteren, extrapulmonalen Beschwerden [9].
Erste radiologische Beobachtungen zeigen, dass verschiedene Veränderungen nach COVID-19 in der Lunge auftreten können [10]. Die klinischen Erfahrungen beinhalten verschiedene pulmonale Folgeerscheinungen. Hierzu gehören Symptome wie Husten bei postviraler bronchialer Hyperreagibilität, Infiltrate und Entzündungszeichen bei organisierender Pneumonie, aber auch fibrotische Veränderungen werden beobachtet und als mögliche Folgeschäden diskutiert [11].
In ersten Studien wurden, abhängig von der eingeschlossenen Patientengruppe, mehr oder weniger fortbestehende Einschränkungen beobachtet. So zeigten sich drei [12] oder vier Monate nach Infekt insbesondere Störungen der Sauerstoffaufnahme [13]. Diese traten besonders nach schweren Verläufen auf [14]. Erste Berichte aus chinesischen Beobachtungsstudien zeigen ähnliche Einschränkungen auch noch nach sechs Monaten [15] Interessanterweise finden sich bei schweizerischen Militärrekruten im Vergleich zur Leistungsfähigkeit vor COVID-19-Infekt Einschränkungen der Leistungsfähigkeit nach milden Verläufen [16]. Wie sich diese Veränderungen weiterentwickeln und welche Behandlungsmöglichkeiten bestehen, ist unklar und Gegenstand aktueller Forschungsprojekte. Ein möglicher Ansatz zur Besserung der Symptome dieser Personen ist eine ambulante oder stationäre pulmonale Rehabilitation [17]. Die postvirale bronchiale Hyperreagibilität kann empirisch mit inhalativen Steroiden behandelt werden. Obstruktive Lungenfunktionsstörungen können ggf. von einer Asthma-Therapie profitieren. Bei interstitiellen Veränderungen im Sinn einer organisierenden Pneumonie werden systemische Steroide nach Ausschluss eines Infekts diskutiert [18]. Eine antifibrotische Therapie wurde bei fibrotischen Lungenparenchymveränderungen vorgeschlagen [19] und wird aktuell in klinischen Studien geprüft. Generell fehlt für alle Behandlungsansätze im Moment eine fundierte wissenschaftliche Evidenz, und mögliche iatrogene Nebeneffekte müssen sorgfältig gegenüber dem potenziellen Nutzen abgewogen werden. Idealerweise sollten diese Patientinnen und Patienten in prospektive randomisierte Studien und auch Beobachtungsstudien (wie zum Beispiel die Swiss COVID Lung Study [14]) eingeschlossen werden, um diese Evidenzlücke zu schliessen.
Neurologische Folgeschäden
Häufig leiden Menschen nach COVID-19-Infekt an persistierender Müdigkeit. Hierbei spielt insbesondere das postinfektöse Müdigkeits-/Fatigue-Syndrom eine zentrale Rolle. Diese Form des «Fatigue-Syndroms» war schon vor der SARS-CoV-2-Pandemie bekannt, da es zum Beispiel sechs Monate nach einer Infektion mit Epstein-Barr-Virus (EBV) mit einer Häufigkeit von 9–22 % vorliegt [20]. Auch im Rahmen lokal begrenzter Ausbrüche von Infektionskrankheiten kam es in der Folge zu postinfektösen Fatigue-Syndromen. Zuletzt trat es nach einem Ausbruch einer Giardia-lamblia-Enteritis im Jahr 2004 in Norwegen auf [21]. Nach einer SARS-CoV-2-Infektion berichten im Mittel nach zehn Wochen immer noch 50 % der Betroffenen über eine alltagsrelevante Fatigue, die nicht mit der initialen Schwere der Erkrankung assoziiert ist [22]. Die Fatigue ist nicht ausschliesslich an das Szenario einer Dysregulation des Immunsystems nach Infektion gebunden, sondern auch inhärent mit autoimmunen Erkrankungen wie zum Beispiel der Multiplen Sklerose (MS) assoziiert. Bei MS-Erkrankten gehört sie zu den drei am meisten die Lebensqualität beeinträchtigenden Symptomen. Dennoch ist unser medizinisches Verständnis dieses Beschwerdebilds sowie seine Therapie leider weiterhin limitiert [23]. Ebenso wie bei der Fatigue im Rahmen einer etablierten autoimmunen Erkrankung geht auch das postinfektiöse Fatigue-Syndrom mit einer relevanten Beeinträchtigung der physischen und seelischen Gesundheit mit konsekutiv reduzierter Lebensqualität einher. Dies ist insbesondere gegeben, wenn das postinfektiöse Fatigue-Syndrom in ein chronisches Erschöpfungssyndrom übergeht [24]. Die Bedeutung dieses Zustandsbilds wird – allein die aktuellen SARS-CoV-2-Infektionszahlen berücksichtigend [25] – für eine Zeit lang immer mehr in den Vordergrund unserer täglichen klinischen Arbeit rücken. Hierbei ist es wichtig, dieses medizinisch schwierig zu fassende Beschwerdebild mit den Betroffenen aktiv zu thematisieren, somatische Ursachen sowohl internistisch als auch neurologisch auszuschliessen und anschliessend die Erkrankten zeitnah einer symptomatischen Therapie zuzuführen, sofern alltagsrelevante Einschränkungen vorliegen. Die Therapie sollte multimodalen Ansätzen folgen, da die Ursachen der Fatigue vielfältig sind. Ohne dass diese Empfehlung der Einleitung einer zeitnahen Therapie derzeit – wegen der Kürze dieses Krankheitsbilds nach SARS-CoV-2-Infektion – mit Zahlen belegbar wäre, halten wir dennoch vorerst an dieser Einschätzung fest, da diese Empfehlung bei vielen Erkrankten nachweislich richtig ist und positive Effekte auf unterschiedliche Outcome-Parameter hat. Bei Müdigkeit helfen generell eine gute Schlafhygiene und Strategien zur Bewältigung des Alltags einschliesslich Planung der Aktivitäten, angepasstes Tempo, Prioritätensetzen und Anpassung der Umgebung. Zusätzlich sind Therapien von Begleiterkrankungen, z.B. Depression oder Angststörungen, zu diskutieren und körperliche Aktivität zu empfehlen.
Kardiovaskuläre Spätfolgen der COVID-19-Infektion
Unter den vielen extrapulmonalen Manifestationen von COVID-19 wurde beobachtet, dass das Herz-Kreislauf-System besonders betroffen ist. Kardiovaskuläre Komorbiditäten wie arterielle Hypertonie, koronare Herzkrankheit, Herzinsuffizienz oder Arrhythmie wurden als Risikofaktoren für schwere COVID-19-Verläufe identifiziert [26, 27].
In der akuten Phase der COVID-19-Infektion wurden folgende kardiale Manifestationen beobachtet (Liste nicht erschöpfend): Myokardschädigung/Myokarditis, Herzrhythmusstörungen, kardiogener Schock, Takotsubo-Kardiomyopathie, myokardiale Ischämie, thromboembolische Komplikationen und akutes Cor pulmonale (zuletzt wegen kardialer und/oder pulmonaler COVID-19-assoziierter Schäden und/oder Lungenembolie mit erhöhtem pulmonalarteriellem Druck). Die möglichen zugrundeliegenden Mechanismen, die die Pathophysiologie von SARS-CoV-2 in Bezug auf das kardiovaskuläre System erklären können, sind Endothelzellschäden/-entzündung, eine Dysregulation des Renin-Angiotensin-Aldosteron-Systems oder eine Dysregulation der Immunantwort (Zytokinsturm) und die direkte Virustoxizität im Herzkreislaufgewebe [28]. Bei Personen, die an COVID-19 gelitten haben, gibt es noch keine Daten für das langfristige kardiovaskuläre Outcome. Die initiale myokardiale Schädigung bei COVID-19-Erkrankten, die bis zu 20 % betrug [29], und die angezeigte kardiale Beteiligung (78 % der Betroffenen) sowie die anhaltende myokardiale Entzündung (60 % der Betroffenen) in einer kardiovaskulären magnetresonanztomografischen Studie, die 71 Tage nach der Infektion durchgeführt worden war [30], deuten die Entwicklung chronischer Herzprobleme einschliesslich Herzinsuffizienz und Herzrhythmusstörungen an. Durch die Beeinflussung der endothelialen Funktion und die Gefässentzündung kann SARS-CoV-2 das Risiko für eine arterielle Hypertonie sowie thrombembolische Ereignisse einschliesslich Myokardinfarkt und Schlaganfall erhöhen. Viele Menschen berichten nach einer COVID-19-Infektion über chronische Müdigkeit, Thoraxschmerzen, Dyspnoe und/oder Palpitationen. Daher besteht bei diesem Patientenkollektiv die Notwendigkeit einer sorgfältigen kardialen Standortbestimmung und die Implementierung eines kardialen Follow-ups.
Rheumatologische und immunologische Langzeitschäden
Neben kardialen und neurologischen Auffälligkeiten werden bei Personen mit Long COVID persistierende Myalgien, Arthralgien und eine Sicca-Symptomatik beklagt [31], zum Teil begleitet von einer (leichten) CRP-Erhöhung.
Ähnliche Initialsymptome finden sich auch bei rheumatischen Erkrankungen wie z.B. Konnektividen, Vaskulitiden oder Arthritiden, was die Unterscheidung von Long COVID von einer Autoimmunerkrankung erschweren kann. Die zugrundeliegende Pathophysiologie beim Long COVID scheint v.a. jedoch die Folge einer SARS-CoV2-induzierten Mikroangiopathie und einer Dysregulation des Renin-Angiotensin-Aldosteron-Systems zu sein [32, 28].
Keine Long-COVID-, sondern eine Post-COVID-19-getriggerte Erkrankung stellt das multisystemische inflammatorische Syndrom (MIS) bei Kindern und Jugendlichen dar (MIS-C), das zwei bis sechs Wochen nach COVID-19 auftritt und Ähnlichkeiten mit dem Kawasaki-Syndrom, einer Vaskulitis mittlerer Gefässe des Kindesalters, aufweist. Häufig Infekt-getriggert, präsentiert sich das Kawasaki-Syndrom klinisch mit Fieber (mind. 5d), beidseitiger Konjunktivitis, Schleimhautveränderungen («Erdbeerzunge»), einem Hautausschlag und zervikaler Lymphadenopathie. Unbehandelt entwickeln ca. 20 % der Kinder eine Koronaritis [33].
Das MIS-C ist definiert als hospitalisationspflichtige Erkrankung mit Fieber, erhöhter humoraler Entzündungsaktivität und Multiorgandysfunktion im Kontext einer SARS-CoV-2-Infektion. Es handelt sich dabei um eine Ausschlussdiagnose [34]. Im Gegensatz zum Kawasaki-Syndrom sind die Kinder älter (>5 Jahre), weisen häufiger eine gastrointestinale Beteiligung auf und präsentieren sich bereits initial mit Herzversagen oder im kardiogenen Schock [35]. Erst kürzlich wurde dieses Krankheitsbild auch bei jungen Erwachsenen beschrieben (MIS-A). Laborchemisch zeigt sich i.d.R. eine starke Erhöhung von CRP, Ferritin, D-Dimeren und Interleukin-6 [36]. Interessanterweise waren bei ca. 30 % der Erwachsenen und 45 % der Kinder mit MIS die SARS-CoV-2-PCR- und -Antigentests negativ bei positivem Nachweis von Anti-SARS-CoV-2-Antikörpern (AK) [36]. Pathophysiologisch spielen Mikroangiopathie, Dysregulation des Immunsystems mit auch Aktivierung der Komplement- und Gerinnungskaskaden eine Rolle. Kürzlich wurde eine gesteigerte, post-infektiöse Autoreaktivität gegenüber Antigenen diverser betroffener Organsysteme beschrieben. An bekannten Auto-AK wurden lediglich Anti-La-IgG (assoziiert mit Sjögren-Syndrom und systemischem Lupus erythematosus) und Anti-Jo-IgG (assoziiert mit Antisynthetasesyndrom) detektiert [37].
Zur Behandlung des MIS wurden bisher v.a. hochdosierte Kortikosteroide, intravenöse Immunglobuline und zytokininhibierende Therapien wie z.T. Anti-IL-6R zusammen mit Antikoagulation erfolgreich eingesetzt [38, 39].
Dermatologische Manifestationen
Im akuten Stadium der Krankheit werden vor allem paravirale Exantheme beobachtet, die mit verschiedenen Morphologien auftreten (morbilliform, varizelliform, urtikariell, makulopapulös, usw.) [40, 41]. Diese sind nicht spezifisch und werden bei vielen viralen Infektionen gesehen. Besondere kutane Manifestationen von COVID sind die Pernio-artige Hautveränderungen, die an Frostbeulen erinnern, und die vor allem bei Gesunden mit negativen PCR- und serologischen Befunden auftreten [42]. Vermutet wird entweder eine verspätete Antikörper-Antwort, dass die virale Last zu niedrig war, um Antikörper zu induzieren, oder dass diese Personen eine frühe und robuste Typ-1-Interferon-Antwort entwickeln, die die virale Replikation unterdrückt [43, 44]. Wahrscheinlich in Zusammenhang mit dem Hyperkoagulabilitätsstatus bei COVID-19 werden auch Livedo reticularis/racemosa und Vasculitis beobachtet. In der bisher einzigen Studie über dermatologische Manifestationen bei Long COVID hatten 7 % der Pernio-like-Patientinnen und -Patienten persistierende Hautveränderungen über 60 Tage, während die anderen Ausschläge nach ein bis zwei Wochen bis zu einem Monat regredient waren [45]. Beschrieben wurden auch Haarausfall im Sinn eines reaktiven telogenen Effluviums [46] oder Stress-bedingte Alopecia areata [47].
Bei schweren Verläufen mit Aufenthalt auf der Intensivstation kann es zusätzlich zu Hautnekrosen und Dekubitus als Komplikationen kommen. Auch diese müssen im Verlauf entsprechend behandelt werden. Eine Hautuntersuchung sollte daher auch bei Long-COVID-Erkrankten nicht fehlen.
Folgeschäden an der Niere
Die Nieren sind neben der Lunge ein wichtiges Zielorgan von SARS-CoV-2. Dabei reicht das Spektrum der Nierenbeteiligung von subklinischen Urinbefunden bis zum schweren dialysepflichtigen akuten Nierenversagen (ANV) [48]. Das Auftreten einer akuten Niereninsuffizienz verschlechtert das Patienten-Outcome signifikant, ist die Mortalität doch bis um das 10-Fache erhöht.
Personen mit bereits bekannter schwerer, chronischer Niereninsuffizienz (CNI) sind aufgrund der hohen Häufigkeit von Komorbiditäten wie Bluthochdruck oder Diabetes anfällig für eine schwer verlaufende COVID-19-Erkrankung.
Bei Personen ohne vorbekannte CNI erholen sich die Nieren zwar in den meisten Fällen, die langfristigen Auswirkungen bleiben jedoch noch unklar. Aus unseren Erfahrungen mit ANV anderer Genese wissen wir, dass, unabhängig von der Ursache dieses ANV, langfristig sowohl eine erhöhte renale Morbidität als auch ein erhöhtes Risiko für nicht-renale, insbesondere kardiovaskuläre und neurologische Erkrankungen bestehen. Ferner ist das Risiko für die Progression zu einer CNI deutlich erhöht [49]. Die KDIGO(Kidney Diseases Improving Global Outcome)-Leitlinien [50] empfehlen daher, dass Menschen mit ANV nach drei Monaten untersucht werden, um festzustellen, ob sich das ANV definitiv erholt hat oder ob eine CNI neu aufgetreten ist, bzw. es zur Progression einer vorbestehenden CNI gekommen ist. Deswegen sollten unseres Erachtens alle Betroffenen mit einem schweren Covid-19-Verlauf bezüglich Nierenfunktion nachuntersucht werden.
Schlussfolgerung
Die mittel- und langfristigen Folgen nach einer akuten COVID-19-Infektion können vielfältig sein und die genaue zeitliche Entwicklung dieser Folgeerscheinungen bzw. Reversibilität ist noch nicht abzuschätzen. Aufgrund der grossen Anzahl von Betroffenen in einer aktuell unkontrollierten Pandemiesituation muss eine interdisziplinäre Betreuung dieser Erkrankten gewährleistet werden. Zudem ist eine bessere Charakterisierung und Beobachtung im Rahmen von systematischen Kohortenstudien wichtig, um das Erkrankungsspektrum des Long-COVID- Syndroms besser zu verstehen und neue Therapieansätze zu prüfen [14]. Zur Betreuung von Long-COVID-Erkrankten werden aktuell schweizweit Long-COVID-Zentren oder -Kliniken gemäss internationalen Vorschlägen etabliert [51]. In Bern bietet die Inselgruppe ein solches interdisziplinäres Long-COVID-Zentrum an. Zudem braucht es dringend Empfehlungen zur Behandlung von Menschen mit Long COVID, um deren Symptomatik und Prognose zu verbessern [52].
- 1.Was ist ein Long COVID? (Mehrfachauswahl)
- a)Eine schwerwiegende COVID-Erkrankung mit ARDS
- b)Eine über Wochen oder Monate dauernde pulmonale oder extrapulmonale Symptomatik
- c)Eine Einschränkung einer Organfunktion nach abgeklungenem Virusinfekt
- d)Eine mögliche Folge nach mildem Infekt
- e)Eine mögliche Folge nach schwerem Infekt
- 2.Für Long COVID gibt es... (Mehrfachauswahl)
- a)klare Therapieempfehlungen.
- b)eine internationale Definition.
- c)keine Behandlung.
- d)laufende Studien.
- e)spezialisierte Long-COVID-Zentren.
Antworten zu den Lernfragen
1. Antworten b), c), d) und e) sind richtig.
2. Antworten d) und e) sind richtig.
Bibliografie
. Severe acute respiratory syndrome: Clinical outcome and prognostic correlates. Emerg Infect Dis. 2003;9(9):1064–1069. DOI: 10.3201/eid0909.030362.
, The 1-year impact of severe acute respiratory syndrome on pulmonary function, exercise capacity, and quality of life in a cohort of survivors. Chest. 2005;128(4):2247–2261. DOI: 10.1378/chest.128.4.2247.
. SARS and MERS: Recent insights into emerging coronaviruses. Nat Rev Microbiol. 2016;14(8):523–534. DOI: 10.1038/nrmicro.2016.81.
, Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395(10223):497–506. DOI: 10.1016/S0140-6736(20) 30183-5.
. Pathogenesis of COVID-19-induced ARDS: Implications for an ageing population. Eur Respir J. 2020;56(3):2002049. DOI: 10.1183/13993003.02049-2020.
, Functional disability 5 years after acute respiratory distress syndrome. N Engl J Med. 2011;364(14):1293–304. DOI: 10.1056/nejmoa1011802.
. Immune determinants of COVID-19 disease presentation and severity. Nat Med. 2021;27(1):28–33. DOI: 10.1038/s41591-020-01202-8.
. COVID-19 rapid guideline: managing the long-term effects of COVID-19. NICE Guidel. 2020.
. Persistent symptoms in patients after acute COVID-19. JAMA. 2020;324(6):603–605. 2020. DOI: 10.1001/jama.2020.12603.
. Imaging in the aftermath of COVID-19: what to expect. Eur Radiol. 2020;1–3. DOI: 10.1007/s00330–020-07465-6.
, Pulmonary fibrosis secondary to COVID-19: a call to arms? Lancet Respir Med. 2020;S2213-2600(20)30222-8.
, Follow-up study of the pulmonary function and related physiological characteristics of COVID-19 survivors three months after recovery. EClinicalMedicine. 2020;25:100463. DOI: 10.1016/j.eclinm.2020.100463.
, Respiratory and psychophysical sequelae among patients with COVID-19 four months after hospital discharge. JAMA Netw Open. 2021;4(1):e2036142.
, Pulmonary function and radiological features four months after COVID-19: first results from the national prospective observational Swiss COVID-19 lung study. Eur Respir J. 2021; : 2003690. DOI: 10.1183/13993 003.03690-2020.
, 6-month consequences of COVID-19 in patients discharged from hospital: a cohort study. Lancet;397(10270):220–232 . 2021. DOI: 10.1016/S0140-67 36(20)32656-8.
. Reduced maximal aerobic capacity after COVID-19 in young adult recruits, Switzerland, May 2020. Eurosurveillance. 2020;25(36):2001542. DOI: 10.2807/1560-7917.ES. 2020.25. 36.2001542.
. COVID-19: Interim fuidance on rehabilitation in the hospital and post-hospital phase from a European Respiratory Society and American Thoracic Society-coordinated International Task Force. Eur Respir J. 2020;56(6):2002197. DOI: 10.1183/ 13993003.02197-2020.
, Persistent post-COVID-19 inflammatory interstitial lung disease: An observational study of corticosteroid treatment. Ann Am Thorac Soc. 2021. DOI: 10.1513/annalsats.202008-1002oc.
. Pulmonary fibrosis and COVID-19: the potential role for antifibrotic therapy. Lancet Respir Med. 2020 Aug;8(8):807–815.
, The international collaborative on fatigue following infection (COFFI). Fatigue Biomed Heal Behav. 2018;6(2):106–121. DOI: 10.1080/21641846. 2018.1426086.
. From good health to illness with post-infectious fatigue syndrome: a qualitative study of adults’ experiences of the illness trajectory. BMC Fam Pract. 2017;18(1):49. DOI: 10.1186/s12875-017-0614-4.
, Persistent fatigue following SARS-CoV-2 infection is common and independent of severity of initial infection. PLoS One. 2020;15(11):e0240784. DOI: 10.1371/journal.pone.0240784.
. Fatigue in multiple sclerosis: Mechanisms, evaluation, and treatment. Sleep. 2010;33(8):1061–1067. DOI: 10.1093/sleep/33.8.1061.
. A systematic review describing the prognosis of chronic fatigue syndrome. Occup Med (Chic Ill). 2005;55(1):20–31. DOI: 10.1093/occmed/kqi013.
. Coronavirus: Situation Schweiz. BAG; Bern,: 2021. https://www.bag.admin.ch/bag/de/home/krankheiten/ausbrueche-epidemien-pandemien/aktuelle-ausbrueche-epidemien/novel-cov/situation-schweiz-und-international.html; letzter Zugriff: 22.03.2021.
. Coronavirus disease 2019 (COVID-19) and cardiovascular risk: A meta-analysis. Prog Cardiovasc Dis. 2020;4:527–528.
. COVID-19 and renin angiotensin blockers: current evidence and recommendations. Circulation. 2020;141(25):2042–2044. DOI: 10.1161/CIRCULATIONAHA.120.047022.
, Extrapulmonary manifestations of COVID-19. Nat Med. 2020;26(7):1017–1032. DOI: 10.1038/s41591-020-0968-3.
. Special Article – Acute myocardial injury in patients hospitalized with COVID-19 infection: A review. Prog Cardiovasc Dis. 2020;63(5):682–689. DOI: 10.1016/j.pcad.2020.05.013.
, Outcomes of cardiovascular magnetic resonance imaging in patients recently recovered from Coronavirus Disease 2019 (COVID-19). JAMA Cardiol. 2020;5(11):1308. DOI: 10.1001/jamacardio.2020. 3557.
, Multi-organ impairment in low-risk individuals with long COVID. medRxiv. 2020: DOI: https://doi.org/10.1101/2020.10.14.20212555.
, Endothelial cell infection and endotheliitis in COVID-19. Lancet. 2020;395(10234):1417–1418. DOI: 10.1016/S0140-6736(20)30937-5.
, Diagnosis, treatment, and long-term management of Kawasaki disease: A scientific statement for health professionals from the American Heart Association. Circulation. 2017;135(17):e927–e999. DOI: 10.1161/CIR.0000000000000484
Centers for Disease Control and Prevention (CDC) . Multisystem inflammatory syndrome in children (MIS-C) associated with coronavirus disease 2019 (COVID-19). 2020. https://emergency.cdc.gov/han/2020/han00432.asp; letzter Zugriff: 22.03.2021., Clinical characteristics of 58 children with a pediatric inflammatory multisystem syndrome temporally associated with SARS-CoV-2. JAMA. 2020;324(3):259–269.
, Case series of multisystem inflammatory syndrome in adults associated with SARS-CoV-2 infection – United Kingdom and United States, March–August 2020. MMWR Morb Mortal Wkly Rep. 2020;69(40): 1450–1456. DOI: 10.15585/mmwr.mm6940e1.
, Mapping systemic inflammation and antibody responses in multisystem inflammatory syndrome in children (MIS-C). Cell. 2020;183(4):982–995.e14. DOI: 10.1016/j.cell.2020.09.034.
, Multisystem inflammatory syndrome in children and COVID-19 are distinct presentations of SARS–CoV-2. J Clin Invest. 2020;130(11):5967–5975. DOI: 10.1172/JCI140970.
, The Immunology of multisystem inflammatory syndrome in children with COVID-19. Cell. 2020;183(4):968–981.e7. DOI: 10.1016/j.cell.2020.09.016.
, The spectrum of COVID-19-associated dermatologic manifestations: An international registry of 716 patients from 31 countries. J Am Acad Dermatol. 2020;83(4):1118–1129. DOI: 10.1016/j.jaad.2020.06.1016.
. Cutaneous manifestations of COVID-19: a systematic review and analysis of individual patient-level data. Dermatol Online J. 2020;26(12):13030/qt7s34p8rw. PMID: 33423412.
, Pernio-like skin lesions associated with COVID-19: A case series of 318 patients from 8 countries. J Am Acad Dermatol. 2020;83(2):486–492. DOI: 10.1016/j.jaad.2020.05.109.
, Chilblain-like lesions during the COVID-19 pandemic: a serological study on a case series. Br J Dermatol. 2020;183(4):782–784. DOI: 10.1111/bjd.19348.
, Clinical, laboratory, and interferon-alpha response characteristics of patients with Chilblain-like lesions during the COVID-19 pandemic. JAMA Dermatol. 2021;157(2):202–206. DOI: 10.1001/jama dermatol.2020.4324.
, Long COVID in the skin: a registry analysis of COVID-19 dermatological duration. Lancet Infect Dis. 2021;21(3):313–314. DOI: 10.1016/s1473-3099(20)30986-5.
, SARS-CoV-2-induced telogen effluvium: a multicentric study. J Eur Acad Dermatol Venereol. 2020;35(3):e181-e183. DOI: 10.1111/jdv.17045.
. COVID-19: association with rapidly progressive forms of alopecia areata. Int J Dermatol. 2021;60(1):127. DOI: 10.1111/ijd.15317.
. Targeting acute kidney injury in COVID-19. Nephrol Dial Transplant. 2020;35(10):1652–1662. DOI: 10.1093/ndt/gfaa231.
. Pathophysiology of AKI to CKD progression. Semin Nephrol. 2020;40(3):328. DOI: 10.1016/j.semnephrol.2020.01.011.
KDIGO Clinical Practice Guideline for Acute Kidney Injury . Kidney International. 2012;2,1. https://kdigo.org/wp-content/up loads/2016/10/KDIGO-2012-AKI-Guideline-English.pdf; letzter Zugriff: . 22.03.2021., The Johns Hopkins Post-Acute COVID-19 Team (PACT): A multidisciplinary, collaborative, ambulatory framework supporting COVID-19 survivors. Am J Med. 2021:S0002–9343(20)31174–8. DOI: 10.1016/j. amjmed.2020.12.009.
, Long COVID guidelines need to reflect lived experience. Lancet. 2020;397(10273):455–457. DOI: 10.1016/s0140–6736(20)32705-7.