Therapie der Herzinsuffizienz mit reduzierter Auswurffraktion: Was ist neu in den Leitlinien 2021?
Abstract
Zusammenfassung: Das Spektrum der Optionen zur Behandlung der Herzinsuffizienz mit reduzierter Auswurffraktion (Heart Failure with reduced Ejection Fraction, HFrEF) hat sich in den vergangenen Jahren deutlich erweitert. Die nun publizierten Leitlinien von 2021 der Europäischen Gesellschaft für Kardiologie haben einen neuen Therapie-Algorithmus für Personen mit HFrEF und damit den Stellenwert der verschiedenen Medikamente und Interventionen definiert. Neu ist eine Basistherapie bestehend aus vier Medikamenten mit unterschiedlichen Wirkmechanismen für alle Menschen mit HFrEF indiziert: ein ACE-Hemmer (Angiotensin-Converting Enzyme Inhibitor), ein Betablocker, ein Mineralokortikoid-Rezeptor-Antagonist und ein SGLT-2-Hemmer (Sodium Glucose Co-Transporter-2 Inhibitor). Weitere Massnahmen sollen in Abhängigkeit vom Ansprechen auf diese maximal auftitrierte 4-Säulen-Basistherapie und vom Phänotyp diskutiert und angewendet werden. Im vorliegenden Artikel diskutieren wir die verfügbaren Medikamente und Interventionen, deren Stellenwert im Behandlungsalgorithmus und relevante praktische Aspekte der modernen HFrEF-Therapie.
Abstract: The spectrum of treatment options for patients with heart failure with reduced ejection fraction (HFrEF) has substantially expanded over the last years. The 2021 guidelines of the European Society of Cardiology propose a new treatment algorithm for patients with HFrEF and define the role of the currently available drugs, interventions and devices in this context. The new standard is a basic therapy consisting of four drugs with different mechanisms of action for all patients with HFrEF: an angiotensin-converting enzyme inhibitor, a betablocker, a mineralocorticoid antagonist, and a sodium glucose co-transporter-2 inhibitor. Additional drugs and/or interventions/devices are indicated depending on the response to the four-drug basic therapy (which has to be up-titrated to the maximally tolerated doses) and the clinical phenotype. In the present article, we discuss the available drugs and devices, their role in the proposed HFrEF treatment algorithm and clinically relevant practical aspects.
Résumé. L’éventail des options de traitement des patients souffrant d’insuffisance cardiaque à fraction d’éjection réduite (Heart Failure with reduced Ejection Fraction; HFrEF) s’est considérablement élargi ces dernières années. Les directives 2021 de la Société européenne de cardiologie, qui viennent d’être publiées, ont défini un nouvel algorithme thérapeutique pour les patients atteints d’HFrEF et, par conséquent, la place des différents médicaments et interventions. Désormais, un traitement de base composé de quatre médicaments aux mécanismes d’action différents est indiqué pour tous les patients atteints d’HFrEF un inhibiteur de l’enzyme de conversion de l’angiotensine, un bêtabloquant, un antagoniste des récepteurs aux minéralocorticoïdes et un inhibiteur du co-transporteur 2 du glucose sodique. D’autres mesures doivent être discutées et appliquées en fonction de la réponse à ce traitement de base à 4 piliers titré au maximum ainsi que du phénotype. Dans cet article, nous discutons des médicaments et des interventions disponibles, de leur place dans l’algorithme de traitement et des aspects pratiques pertinents du traitement moderne de l’HFrEF.
Im Artikel verwendete Abkürzungen
ACE Angiotensin-Converting Enzyme
ACE-I Angiotensin-Converting Enzyme Inhibitor
ARB Angiotensin-Rezeptor-Blocker
ARNI Angiotensin-Rezeptor-Neprilysin-Inhibitor
BNP B-type Natriuretic Peptide
CRT Cardiac Resynchronization Therapy
HFmrEF Heart Failure with mildly reduced Ejection Fraction HFpEF Heart Failure with preserved Ejection Fraction
HFrEF Heart Failure with reduced Ejection Fraction
ICD Implantable Cardioverter Defibrillator
LSB Linksschenkelblock
LVEF Left Ventricular Ejection Fraction
MRA Mineralokortikoid-Rezeptor-Antagonist
NT-proBNP N-Terminal-pro-B-type Natriuretic Peptide
NYHA New York Heart Association
SGLT-2-I Sodium Glucose Co-Transporter-2 Inhibitor
Die Therapie der Herzinsuffizienz ist in den vergangenen Jahren durch die Einführung verschiedener neuer Substanzen erheblich komplexer geworden. Die im Jahr 2021 publizierten neuen Leitlinien der Europäischen Gesellschaft für die Kardiologie (European Society of Cardiology; ESC) haben diese Medikamente und Interventionen in einen neuen Therapie-Algorithmus eingeordnet [1]. Prognose-verbessernde Massnahmen stehen weiterhin praktisch nur für Personen mit Herzinsuffizienz und reduzierter Auswurffraktion (Heart Failure with reduced Ejection Fraction, HFrEF) zur Verfügung. Im vorliegenden Artikel fassen wir die aktuelle Therapie der HFrEF basierend auf den ESC-Leitlinien von 2021 zusammen und heben Neuerungen hervor.
Definition und Diagnose
Eine detaillierte Abhandlung der Diagnostik der Herzinsuffizienz würde den Rahmen dieses Artikels sprengen. Einige wichtige Aspekte sind einleitend aber unverzichtbar. Für die Diagnose und Klassifikation einer Herzinsuffizienz ist eine Echokardiografie immer erforderlich, auch wenn die Diagnose klinisch und mit Hilfe von natriuretischen Peptiden oft sehr wahrscheinlich gemacht werden kann (Abb. 1). Die aktuelle Einteilung der Herzinsuffizienz gemäss linksventrikulärer Auswurffraktion (Left Ventricular Ejection Fraction; LVEF) ist in Abb. 2 dargestellt [1]. Der Grenzwert von 40% für die Definition einer HFrEF ergibt sich aus der Tatsache, dass dieser Wert (oder manchmal auch 35%) das Einschlusskriterium für die grossen Studien darstellte, welche die heutige Therapie definiert haben. Für Menschen mit Herzinsuffizienz und erhaltener LVEF (Heart Failure with preserved Ejection Fraction; HFpEF; LVEF ≥50%) gibt es sehr wenig Evidenz für den prognostischen Nutzen der klassischen HFrEF-Medikation. Der Graubereich der LVEF 41–49% wird heute neu als Herzinsuffizienz mit leicht eingeschränkter LVEF (Heart Failure with mildly reduced Ejection Fraction; HFmrEF) bezeichnet. Post-hoc-Studien von «HFpEF-Studien» (die typischerweise nicht nur Personen mit einer LVEF ≥50%, sondern Personen mit einer LVEF bis zu 40% eingeschlossen haben) weisen darauf hin, dass die bei HFrEF wirksamen Medikamente auch bei HFmrEF effektiv sind.


Prinzip der Therapie – Neuerungen gegenüber 2016
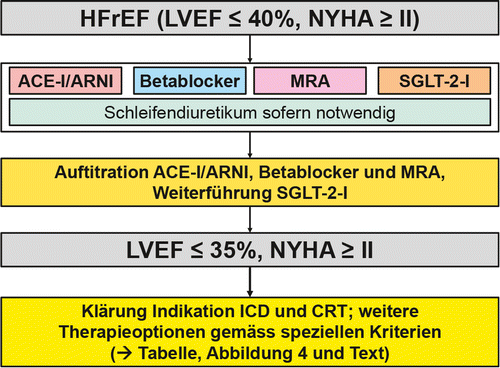
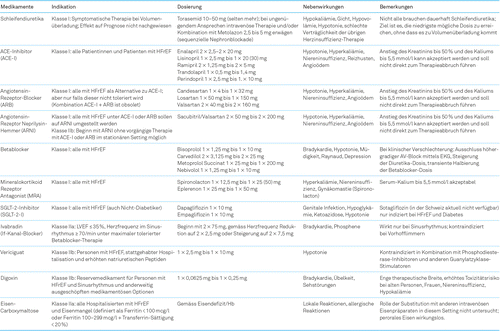
Wenn immer möglich müssen ein kausaler Therapieansatz und die Ursachen-unabhängige Standardtherapie kombiniert werden. Entsprechend ist im Abklärungsgang die Suche nach möglichen Ursachen einer HFrEF wichtig (z.B. koronare Herzkrankheit, Tachykardie, Klappenerkrankung, Hämochromatose, Hypothyreose, Alkoholüberkonsum). Falls eine mögliche Ursache der Herzinsuffizienz bzw. ein Co-Faktor identifiziert werden kann, muss dieser behandelt werden (z.B. Revaskularisation, Frequenz- oder Rhythmuskontrolle eines tachykarden Vorhofflimmerns). Daneben muss die medikamentöse Therapie etabliert werden, wobei sich das Prinzip gegenüber den ESC-Leitlinien 2016 [2] geändert hat: Während bisher eine Therapieeskalation von der Basistherapie aus ACE-Hemmer (Angiotensin-Converting Enzyme Inhibitor, ACE-I) oder einem Angiotensin-Rezeptor-Blocker (ARB) und einem Betablocker auf einen Mineralokortikoid-Rezeptor-Antagonisten (MRA) nur bei fehlender Verbesserung der LVEF und der Symptomatik vorgesehen war [2], ist neu eine Basistherapie bestehend aus vier Substanzen mit vier verschiedenen Wirkmechanismen für alle Behandelten Standard (Abb.3) [1], die sogenannte 4-Säulen-Basistherapie. Grundlage dafür ist die Annahme, dass eine möglichst frühe Hemmung aller vier pathophysiologischen Pathways wichtig ist, auch wenn nicht für alle Substanzen Maximaldosierungen erreicht werden können [3, 4]. In Abb.4 sind die verfügbaren Therapien und deren Empfehlungsgrad für Personen mit HFrEF zusammengefasst. In Tabelle 1 sind detaillierte Angaben zu den diskutierten Medikamenten aufgeführt. Konzeptionell handelt es sich nicht primär nur um eine Symptom-orientierte Therapie, sondern ganz klar – sehr ähnlich einer onkologischen Therapie – um eine Prognose-verbessernde Therapie. Dieses Verständnis ist essenziell, da dies auch die Haltung gegenüber potenziellen Nebenwirkungen beeinflussen wird. Während bei onkologischen Therapien erhebliche Toxizitäten allgemein akzeptiert werden, trifft dies für die Herzinsuffizienz kaum zu, obschon eine HFrEF auch in der aktuellen Therapie-Ära eine ähnliche schlechte oder schlechtere Prognose als viele Tumorerkrankungen aufweist und somit aus prognostischer Sicht eine maligne Erkrankung ist [5].
Basistherapie
Diuretika
Schleifendiuretika sind symptomatisch sehr effektiv und bei Volumenüberladung klar indiziert. Dementsprechend liegt eine Klasse I (stärkste Empfehlung, basierend auf einem hohen Evidenzgrad) für diese Substanzklasse vor [1]. Dieser Empfehlungsgrad beruht allerdings auf einer einzigen randomisierten Studie, welche zwei verschiedene Furosemid-Regimes bei dekompensierten Patientinnen und Patienten untersucht hat [6]. Ein prognostisch günstiger Effekt ist für Schleifendiuretika gegenüber Placebo aber nicht nachgewiesen. Vielmehr ist eine hohe Schleifendiuretika-Dosis prognostisch ungünstig [7]. Wahrscheinlich ist dies nicht direkt kausal erklärt, sondern dadurch, dass eine hohe Schleifendiuretika-Dosis ein Surrogat für eine fortgeschrittene Herzinsuffizienz darstellt. Entsprechend sollen Schleifendiuretika nur gegeben werden, solange dies erforderlich ist, bzw. es soll die tiefstmöglich Dosis für die chronische Therapie angestrebt werden. Eine «Überdiuretisierung» ist zu vermeiden, da im (latent) hypovolämen Zustand die prognostisch relevanten, vasodilatierenden und zum Teil auch leicht diuretisch wirksamen Substanzen aufgrund tiefer Blutdruckwerte schlecht toleriert werden.
Angiotensin-Converting Enyzme Inhibitors, Angiotensin-Rezeptor-Blocker und Angiotensin-Rezeptor-Neprilysin-Inhibitoren
Unverändert gegenüber dem bisherigen Vorgehen bei HFrEF sind ACE-I ein zwingender Bestandteil der Basistherapie. Es wurde nachgewiesen, dass der ARB Candesartan bei denjenigen, die aus irgendeinem Grund nicht mit einem ACE-I behandelt werden konnten, gegenüber Placebo einen ähnlichen Effekt auf Mortalität und Morbidität vermittelt wie ein ACE-I [8]. Allerdings ist die Datenlage insgesamt für ACE-I viel stärker als für ARB, sodass primär ein ACE-I und der ARB nur bei Unverträglichkeit eingesetzt werden soll [1]. Kreatinin und Kalium müssen während der Auftitration von ACE-I oder ARB überprüft werden.
Die Umstellung des ACE-I oder ARB auf den Angiotensin-Rezeptor-Neprilysin-Inhibitor (ARNI) sollte grundsätzlich standardmässig in einem zweiten Schritt erfolgen, falls noch mindestens eine NYHA-II-Symptomatik besteht [1]. Theoretisch zählen auch erhöhte natriuretische Peptide als Kriterium für die Umstellung auf den ARNI [9]. Die Leitlinien haben auf dieses Kriterium aber verzichtet. Zu beachten ist die Notwendigkeit eines 36-stündigen ACE-I-freien Intervalls vor Beginn mit dem ARNI aufgrund des Risikos eines Angioödems. Praktisch bedeutet dies, dass an einem Tag der ACE-I pausiert wird und dass erst am nächsten Tag mit dem ARNI begonnen wird. Bei vorbestehender Therapie mit einem ARB fällt dieses 36-stündige therapiefreie Intervall weg. Falls der Patient vor Umstellung auf den ARNI einen ACE-I oder ARB in der Zieldosis (z.B. Lisinopril 20mg) oder mindestens halben Zieldosis (z.B. Lisinopril 10mg) einnimmt, kann mit Sacubitril/Valsartan 2 × 100mg begonnen werden (nach 2 Wochen Steigerung auf 2 × 200mg). Bei tieferen Dosierungen empfiehlt sich ein Beginn mit 2 × 50mg. Obschon das Risiko einer symptomatischen Hypotonie unter Sacubitril/Valsartan höher ist als mit dem ACE-Hemmer (in der PARADIGM-HF-Studie: Enalapril [9]), haben die Patientinnen und Patienten im untersten Blutdruck-Stratum ebenfalls vom ARNI gegenüber dem ACE-I profitiert, und die absolute Risikoreduktion (kardiovaskulärer Tod oder Hospitalisation wegen Herzinsuffizienz) ist in dieser Gruppe besonders hoch [10]. Interessanterweise ist eine ARNI-Therapie auch mit einer verminderten Inzidenz von Diabetes assoziiert (neben einer reduzierten Progression der Niereninsuffizienz) [11].
Es wird oft diskutiert, ob nicht a priori mit einem ARNI begonnen werden kann/soll. Die Leitlinien bzw. die Literatur geben da eine klare Antwort. Als Standard empfohlen (Klasse I) ist der Einsatz des ARNI nach vorgängiger Etablierung einer ACE-I- oder ARB-Behandlung in möglichst hoher Dosierung [1]. Dies entspricht dem Vorgehen in der PARADIGM-HF-Studie, welche die Evidenz für die Überlegenheit des ARNI gegenüber dem ACE-Hemmer erbracht hat [9]. Dieser Algorithmus soll sicherstellen, dass der Patient den ARNI mit grosser Wahrscheinlichkeit tolerieren wird. Ein direkter Beginn mit dem ARNI ohne vorgängige ACE-I oder ARB-Therapie kann bei Hospitalisierten erwogen werden (Klasse-IIb-Indikation) [1]. Dieses Vorgehen ist gemäss einer Studie in diesem Setting sicher und mit einer stärkeren Reduktion des N-Terminal-pro-B-Type Natriuretic Peptide (NT-proBNP) assoziiert [12]. Klare Outcome-Daten für dieses Szenario existieren aber nicht. Die vorsichtige, aber folgerichtige Empfehlung der ESC-Leitlinien kontrastiert mit den amerikanischen Empfehlung, wo der ARNI «up-front» gegeben werden soll [13].
Betablocker
Die Hemmung der sympathischen Überaktivierung – einem pathophysiologischen Kardinalproblem der Herzinsuffizienz – durch Betablocker ist weiterhin ein Grundpfeiler der HFrEF-Therapie. Für vier Substanzen ist ein prognostischer Nutzen nachgewiesen, nämlich durch Bisoprolol, Carvedilol, Metoprolol Succinat und Nebivolol [1]. Es spielt keine Rolle, ob zuerst ein ACE-I und dann ein Betablocker oder umgekehrt gegeben wird [14]. Wichtig ist der Beginn mit einer tiefen Dosis, damit es nicht zu einem kontraproduktiven Effekt kommt. Trotzdem sind initial Nebenwirkungen wie Müdigkeit und Schwäche möglich. Langfristige Nebenwirkungen wie Schlafstörungen, Depression und Raynaud sind möglich, aber relativ selten. Die Betablocker-Dosis soll sukzessive gesteigert werden, wobei dies langsam erfolgen soll, d.h. Dosisverdopplung frühestens alle zwei Wochen. Der Slogan «start low – go slow – aim high» bleibt gültig. Nicht selten sind wiederholte Versuche eines Therapieausbaus nötig. Der prognostische Effekt des Betablockers (Reduktion Mortalität) bei HFrEF ist proportional zur Reduktion der Herzfrequenz bzw. umgekehrt proportional zu der erreichten Herzfrequenz, wobei die Ziel-Herzfrequenz bei <70/min liegt. Es gibt allerdings auch einen Herzfrequenz-unabhängigen Effekt. Es ist stets zu beachten, dass eine noch so kleine Dosis eines Betablockers besser als gar kein Betablocker ist. Streng genommen vermitteln Betablocker eine Mortalitätsreduktion nur bei HFrEF-Patientinnen und -Patienten mit Sinusrhythmus, während der Effekt bei Vorhofflimmern neutral ist [15]. Mangels guter Alternativen (Verapamil/Diltiazem bei HFrEF kontraindiziert, Digoxin ohne klare Outcome-Daten und potenziell toxisch, Amiodarone für reine Frequenzkontrolle nur in Ausnahmefällen eine Option) sind Betablocker trotzdem auch bei HFrEF und Vorhofflimmern empfohlen. Die Leitlinien halten sogar explizit fest, dass sie keine unterschiedliche Empfehlung für Erkrankte mit HFrEF und Sinusrhythmus oder Vorhofflimmern abgeben [1]. Während ein Asthma eine Kontraindiktion bezüglich Betablocker darstellt, gilt dies nicht für eine chronisch-obstruktive Pneumopathie.
Mineralokortikoid-Rezeptor-Antagonisten
Die Aldosteron-Achse ist essenziell für das myokardiale Remodeling, insbesondere die Ausbildung von Fibrose. Der Einsatz von Aldosteron-Antagonisten – oder korrekt MRA – vermittelt bei Kranken mit dem gesamten Symptomspektrum (NYHA II: Eplerenon, NYHA III//IV: Spironolacton) und additiv zur Basistherapie mit ACE-I und Betablocker eine weitere Mortalitätsreduktion [16, 17]. Neu ist ein MRA unabhängig vom Effekt einer ACE-I- und Betablocker-Therapie bei allen HFrEF-Patientinnen und -Patienten frühzeitig indiziert [1]. Eine wichtige und oft nicht reversible Nebenwirkung von Spironolacton bei Männern ist die Gynäkomastie. Beide MRA führen per se zu einer Erhöhung des Serum-Kaliums, was insbesondere bei chronischer Niereninsuffizienz relevante Folgen haben und den langfristigen Einsatz von MRA bei gewissen HFrEF-Patientinnen und -Patienten limitieren kann. Es gibt aber Strategien, wie das Hyperkaliämie-Risiko reduziert werden kann: Wechsel vom ACE-I auf ARNI (etwas tieferes Kalium [18]), chronische Therapie mit einem adäquat dosierten Schleifendiuretikum (Vermeidung prärenale Niereninsuffizienz) und neue perorale Kaliumbinder, hier primär Patiromer (vgl. unten).
SGLT-2-Hemmer
Die Hemmer des Natrium-Glucose-Co-Transporters 2 (Sodium Glucose Co-Transporter-2 Inhibitor; SGLT-2-I) stellen eine Innovation in der HFrEF-Therapie und mit ihrer Klasse-I-Empfehlung eine entscheidende Neuerung in den Leitlinien dar. Nachdem für Personen mit Diabetes mellitus Typ 2 und breitem kardiovaskulärem Risikoprofil und/oder etablierter atherosklerotischer Erkrankung (Herzinsuffizienz nur zu einem geringen Prozentsatz) in Sicherheitsstudien überraschenderweise ein signifikanter Vorteil beobachtet worden war (reduziertes Risiko für Hospitalisationen wegen Herzinsuffizienz), wurden zwei grosse Studien explizit bei HFrEF durchgeführt [19, 20]. Sowohl Dapagliflozin [19] als auch Empagliflozin [20] waren Placebo bezüglich des kombinierten Endpunktes Tod und Hospitalisationen wegen Herzinsuffizienz klar überlegen. Dieses Ergebnis ist primär durch die Reduktion der Hospitalisationen getrieben. Ein signifikanter Vorteil bezüglich Mortalität konnte nur für Dapagliflozin gezeigt werden [19]. Eine Meta-Analyse der beiden Studien kam aber zum Schluss, dass keine signifikante Heterogenität bezüglich des Effekts auf die Mortalität besteht [21]. Sehr wichtig ist die Tatsache, dass der prognostische Nutzen gleichermassen für Diabetiker und Nicht-Diabetiker nachgewiesen wurde. Die zugrundeliegenden Mechanismen sind noch nicht im Detail geklärt. Die SGLT-2-I haben durch ihren primären Mechanismus einen gewissen diuretischen Effekt (Hemmung der Reabsorption von Glucose und Natrium), der aber insgesamt nicht sehr ausgeprägt ist (ev. Natrium-Resorption weiter distal im Tubulus). Zudem ist dieser Effekt vom Diabetes-Status und der Nierenfunktion abhängig, wobei beide Faktoren aber nicht mit dem klinischen Effekt interagieren. Es werden entsprechend weitere, zum Teil direkt kardiale Effekte postuliert [22]. Kleinere mechanistische Studien haben effektiv eine reverses Remodeling bei HFrEF gezeigt, also eine Grössenreduktion des linken Ventrikels mit Verbesserung der LVEF [23, 24]. Somit sind Dapagliflozin oder Empagliflozin (wahrscheinlich Klasseneffekt) für alle Personen mit HFrEF indiziert, dies ebenso unabhängig vom Effekt der bisher «gültigen» Basistherapie aus ACE-I und Betablocker. Die Leitlinien sprechen für Dapagliflozin und Empagliflozin die gleich starke Empfehlung aus [1]. Die SGLT-2-I haben den Vorteil einer einfachen Anwendbarkeit (eine Dosierung) und des günstigen Nebenwirkungsprofils (nachteilig ist ein erhöhtes Risiko von genitalen Infekten, von Vorteil sind ein geringer Effekt auf Blutdruck, kein Effekt auf Herzfrequenz, kein relevanter Effekt auf Serum-Kalium) und können und sollen sehr früh in der Behandlung der HFrEF (quasi Tag 1) eingesetzt werden.
Praktisches Vorgehen bei der Etablierung der Basistherapie
Während klar empfohlen ist, dass eine Basistherapie, bestehend aus den vier Säulen ACE-I/ARB/ARNI, Betablocker, MRA und SGLT-2-I, früh und unabhängig vom Effekt einer initialen Mono-, dualen und Triple-Therapie eingesetzt werden soll [1], ist das exakte Vorgehen weniger gut definiert. Einige Experten propagieren ein Etablieren und Auftitrieren der Vierfach-Therapie innerhalb von sechs Wochen [25], was ambitiös ist. Wir empfehlen, dass alle vier Substanzklassen in maximal 3–4 Wochen zumindest in niedriger Dosierung (Ausnahme: SGLT-2-I: volle Dosierung von Anfang an) eingesetzt werden. Im stationären Setting mit erleichtertem Monitoring sollten alle vier Medikamente vor Austritt etabliert sein. Die Sequenz und Dosierung hängt vom Blutdruck, der Nierenfunktion und anderen Faktoren ab. Bei relativ hohem Blutdruck wird man frühzeitig den ACE-I in hoher Dosis einsetzen, bei guter Nierenfunktion auch frühzeitig den MRA und bei stabiler Situation kurz darauf auch SGLT-2-I und Betablocker. Bei sehr stark eingeschränkter LVEF wird man den Betablocker sehr tief dosiert beginnen, bei knappem Blutdruck primär SGLT-2-I und sehr niedrig dosiert ACE-I. Bei deutlich eingeschränkter Nierenfunktion wird man eher mit dem Betablocker und SGLT-2-I beginnen, den Effekt einer tiefen Dosis ACE-I beobachten und dann über das weitere Vorgehen entscheiden. Falls das Kalium unter Ausbau des ACE-Hemmers relevant ansteigt, kann vor Beginn mit einem MRA die Umstellung auf den ARNI vorgenommen werden, da dieser gegenüber dem ACE-Hemmer zu einem etwas geringeren Anstieg des Serum-Kaliums führt [18]. Die Therapie muss kontinuierlich re-evaluiert und optimiert bzw. in Abhängigkeit vom Verlauf angepasst werden. Zum einen erlaubt dieser Ansatz eine nochmals verbesserte Behandlung von Personen mit HFrEF mit weiterem prognostischem Benefit. Zum anderen ist die Therapie komplexer geworden und stellt erhöhte Anforderungen an die betreuenden Ärztinnen und Ärzte. Da es unmöglich sein wird, dass Kardiologinnen und Kardiologen den Therapieausbau kontinuierlich selbst durchführen, ist eine optimale Zusammenarbeit zwischen Spezialisten und Grundversorgern nochmals wichtiger geworden.
Ergänzende Massnahmen
Alle Personen mit Herzinsuffizienz (nicht nur HFrEF) sollten geschult werden bezüglich Krankheitsverständnis und Selbstmanagement. Zudem ist für alle mit Herzinsuffizienz ein körperliches Training (primär Ausdauer) empfohlen, am besten im Rahmen einer strukturierten kardialen Rehabilitation.
Weitere Optionen
Falls sich nach Etablieren einer optimalen Basistherapie (alle vier Substanzklassen, maximal mögliche Dosierungen, Wechsel auf ARNI erfolgt) eine Verbesserung der LVEF aus dem HFrEF-Bereich heraus zeigt (LVEF >40% oder sogar «nur» >35%, da dies der Cut-off für den Einschluss in vielen Studien war) und die Patientinnen/Patienten nicht mehr symptomatisch sind (NYHA I), gibt es keine Indikation für einen weiteren Therapieausbau [1]. Allerdings darf die Medikation auch nicht gestoppt oder reduziert werden (ausser Schleifendiuretika oder bei zwingenden Gründen wie Hyperkaliämie). Es wurde kürzlich in einer randomisierten Studie gezeigt, dass eine Reduktion der HFrEF-Therapie in einem relevanten Prozentsatz zu einem Rückfall führt [26]. Diese Studie kann auch in der Diskussion mit Betroffenen hilfreich sein. Falls die LVEF weiterhin eingeschränkt ist (offiziell LVEF ≤35%) und wenn auch nur milde residuelle Symptome (NYHA ≥II) vorhanden sind, müssen zusätzliche Optionen geprüft werden [1]. Diese umfassen Medikamente und Devices/Interventionen (Abb. 3, 4; Tabelle 1).

Ivabradin
Ivabradin hemmt exklusiv den If-Kanal am Sinusknoten und führt so zu einer Reduktion der Herzfrequenz im Sinusrhythmus. Ivabradin wirkt nicht bei Vorhofflimmern und hat keinen Effekt auf die AV-Überleitung oder Inotropie. Das Medikament hat auch keinen direkten Effekt auf den Blutdruck, obschon (zumindest bei koronarer Herzkrankheit, aber ohne HFrEF) ein Anstieg des Schlagvolumens und des systolischen Blutdrucks als Folge der Bradykardie beschrieben wurde [27]. Ivabradin reduziert bei einer Herzfrequenz im Sinusrhythmus ≥70/min trotz maximaler tolerierter Betablocker-Therapie das Risiko einer Hospitalisation [28]. Ein Effekt auf die Mortalität konnte nicht nachgewiesen werden. Das ist aber nota bene für neuere Substanzen (z.B. Vericiguat und Omecamtiv Mecarbil, vgl. unten) auch nicht der Fall. Die Startdosis beträgt 2 × 5mg, wobei je nach Reaktion der Herzfrequenz (Ziel: 50–60/min) die Dosis auf 2 × 2,5mg reduziert oder auf 2 × 7,5mg erhöht werden kann. Ivabradin wird in Kombination mit einer etablieren Betablocker-Therapie in unveränderter Dosis gegeben oder allein, falls gar kein Betablocker toleriert wird [1].
Vericiguat
Dabei handelt es sich um einen Stimulator der löslichen Guanylatzyklase mit dem Resultat einer vermehrten Verfügbarkeit von zyklischem Guanosinmonophosphat mit konsekutiver Vasodilatation. Zusätzlich wird von günstigen Effekten auf das linksventrikuläre Remodeling ausgegangen. In der VICTORIA-Studie reduzierte Vericiguat bei Personen mit HFrEF und vorgängiger Hospitalisation oder ambulanter intravenöser Therapie das Risiko des kombinierten Endpunktes kardiovaskulärer Tod oder Hospitalisation wegen Herzinsuffizienz, wobei auch in diesem Fall das Ergebnis durch eine Reduktion der Hospitalisationen zustande kam [29]. Ein signifikanter Effekt auf die Mortalität konnte nicht nachgewiesen werden. Die VICTORIA-Studie ist die Herzinsuffizienz-Studie, die die kränksten Patientinnen und Patienten eingeschlossen hat (höchstes NT-proBNP und höchste Mortalität der Studien der letzten Jahre) [29]. Ein erhöhtes NT-proBNP war ein Einschlusskriterium. Es ist wichtig festzuhalten, dass diejenigen mit dem höchsten NT-proBNP (ca. 8000ng/l oder mehr) nicht von Vericiguat profitierten, sondern potenziell eher Schaden erlitten [30]. Wahrscheinlich bedeutet dies, dass das Medikament erst nach ausreichender Stabilisierung bzw. Rekompensation eingesetzt werden soll. Die Substanz ist nun neu in der Schweiz zugelassen. Erfahrungen im klinischen Alltag gibt es noch sehr wenig. Die Leitlinien geben für Vericiguat eine Klasse-IIb-Empfehlung (kann verwendet werden) [1]. Vericiguat ist somit eine Option für Erkrankte mit etablierter Basistherapie, kürzlicher Hospitalisation wegen Herzinsuffizienz, aber NT-proBNP <8000ng/l. Wichtig ist, dass der gleichzeitige Einsatz von Phosphodiesterase-Inhibitoren oder anderen Guanylatzyklase-Stimulatoren kontraindiziert ist.
Omecamtiv Mecarbil
Dieser kardiale Myosin-Aktivator hat in einer mechanistischen Studie bei HFrEF zu einem reversen Remodeling (Abnahme des linksventrikulären Volumens, Zunahme des Schlagvolumens) und Reduktion des NT-proBNP geführt [31]. In der GALACTIC-HF-Studie in einer HFrEF-Population ähnlich zur VICTORIA-Studie kam es zu einer Reduktion des Risikos des primären Endpunkts bestehend aus kardiovaskulärem Tod oder einem «Herzinsuffizienz-Ereignis» (primär Hospitalisationen) [32]. Dabei war das signifikante Ergebnis ebenfalls durch den Effekt auf die Hospitalisationen und nicht auf die Mortalität zurückzuführen. Omecamtiv Mecarbil ist in der Schweiz bisher nicht verfügbar, und die ESC-Leitlinien 2021 geben keine Empfehlung ab. Aber das Medikament scheint in einer ähnlichen Population mit einem ähnlichen klinischen Effekt (Reduktion der Hospitalisation) wie Vericiguat wirksam zu sein. Ob die beiden Medikamente additive Wirkung haben, ist unklar, bleibt aufgrund der unterschiedlichen Mechanismen aber möglich. Es ist im Moment offen, welchen Stellenwert Omemamtiv Mecarbil in der HFrEF-Behandlung erlangen wird.
Eisen-Carboxymaltose
Eisenmangel (in diesem Setting definiert als Ferritin <100mcg/l oder Ferritin 100–299mcg/l + Transferrin-Sättigung <20%) ist bei HFrEF häufig und auch ohne Vorliegen einer Anämie prognostisch ungünstig. Eine intravenöse Gabe von Eisen-Carboxymaltose gemäss Eisendefizit verbessert bei HFrEF die Lebensqualität und die Leistungsfähigkeit [33]. Kürzlich wurde zudem gezeigt, dass die Verabreichung von Eisen-Carboxymaltose bei wegen einer kardialen Dekompensation hospitalisierten HFrEF-Patientinnen und Patienten zu einer Reduktion des Risikos einer Re-Hospitalisation führt [34]. Die Leitlinien empfehlen eine Bestimmung des Eisenstatus bei jedem Betroffenen mit HFrEF und eine Therapie mit Eisen-Carboxymaltose bei denjenigen mit Eisenmangel [1]. Zu beachten ist, dass orales Eisen den Effekt nicht reproduzieren kann (wurde explizit untersucht) [35] und dass andere intravenöse Eisen-Präparate bei HFrEF nicht untersucht wurden. Es ist bekannt, dass Eisen-Carboxymaltose zu Hypophosphatämie führen kann. Wie häufig dies bei HFrEF-Patientinnen und -Patienten ist und inwieweit dies klinisch relevant ist, ist unbekannt.
Digoxin
Die Rolle von Digoxin bei HFrEF ist nicht gut definiert. Bei Vorhofflimmern kann Digoxin zur Frequenzkontrolle verwendet werden. Bezüglich Outcome liegen hier widersprüchliche Daten vor. Für Patientinnen und Patienten im Sinusrhythmus wurde in einer sehr frühen Studie (DIG Trial) mit einer rudimentären Basistherapie (ACE-I und Diuretika) eine Reduktion des kombinierten Endpunkts aus Tod und Hospitalisationen wegen Herzinsuffizienz gesehen, wobei dies durch die Reduktion der Hospitalisationen vermittelt war bei neutralem Effekt auf die Mortalität [36]. Es wurde diskutiert, dass dieser Effekt von Digoxin sehr ähnlich sei wie derjenige von Ivabradin (vergleichbare hazard ratio für den kombinierten Endpunkt) [37]. Der Unterschied liegt aber in der Background-Therapie, indem im DIG Trial Betablocker und MRA noch nicht etabliert waren. Digoxin ist somit weiterhin ein Reservemedikament für HFrEF-Patientinnen und -Patienten im Sinusrhythmus, bei denen die anderen Optionen ausgeschöpft sind. Digoxin bekommt in den 2021er Leitlinien eine gleich starke Indikation (IIb) wie Vericiguat, aber eine schwächere als Ivabradin (IIa).
Devices und Interventionen
Wenn auch die Hausärztin oder der Hausarzt nicht direkt die Indikation für die Implantation von Devices oder Durchführung von Interventionen stellen muss, ist ein Grundverständnis bezüglich deren Stellenwert doch wichtig. Nachfolgend werden die wichtigsten Optionen kurz diskutiert.
Defibrillator
Ein Implantable Cardioverter Defbrillator (ICD) ist sekundärprophylaktisch nach einer ventrikulären Arrhythmie mit Kreislaufinstabilität (Maximalvariante: überlebter plötzlicher Herztod) ohne sicher korrigierbare Ursache (z.B. schwere Ischämie) unabhängig von der LVEF indiziert, sofern keine Komorbidität mit einer Einschränkung der Lebenserwartung <1 Jahr besteht. In der Primärprophylaxe besteht eine strenge Indikation (Klasse I) für Personen mit einer ischämischen Ursache der Herzinsuffizienz und auch 40 Tage nach Infarkt persistierender LVEF ≤35% (d.h. grosse Infarktnarbe) trotz dreimonatiger optimaler medikamentöser Therapie [1]. Bei sehr fortgeschrittener Herzinsuffizienz (NYHA IV) und/oder Komorbiditäten mit Lebenserwartung <1 Jahr ist ein ICD nicht empfohlen. Bei nicht-ischämisch bedingter Herzinsuffizienz ist die Evidenz schwächer (Klasse IIa), aber die Kriterien sind die gleichen. Für die Personen mit nicht-ischämischer Herzinsuffizienz liegt nur eine ausreichend grosse Studie vor: Der ICD reduzierte das Risiko des plötzlichen Herztods, aber nicht die Gesamtmortalität [38], sodass hier ein ICD primär für relativ junge Patienten mit wenig Komorbiditäten sinnvoll ist. Der Entscheid für oder gegen einen ICD ist auf dem Papier oft relativ klar, im Individualfall aber häufig doch komplex. Der Schutz vor dem plötzlichen Herztod muss gegen das kleine operative Risiko und die (seltenen) Komplikationen wie Infekt (vor allem bei ICD-Wechsel) und inadäquater Schock (kann traumatisierend sein) abgewogen werden.
Kardiale Resynchronisation
Die Cardiac Resynchronization Therapy (CRT) kann bei breitem Linksschenkelblock zu einem substanziellen reversen Remodeling mit Verbesserung der LVEF führen. Ideale Kandidatinnen und Kandidaten für eine CRT-Implantation sind Personen mit LVEF ≤35%, QRS-Breite ≥150ms und typischer Linksschenkelblock-Morphologie. Falls kein typischer Linksschenkelblock vorliegt, aber der QRS-Komplex sehr breit ist (≥150ms), besteht eine schwächere, aber genügende Evidenz. Bei einer QRS-Dauer von 130–149ms kann die Indikation ebenfalls noch gestellt werden, vor allem, wenn eine typische Linksschenkelblock-Morphologie vorliegt. Eine CRT ist kontraindiziert bei einer QRS-Breite <130ms sofern nicht per se eine Pacing-Indikation aufgrund eines höhergradigen AV-Blocks vorliegt [1].
Revaskularisation
Die koronare Herzkrankheit ist die häufigste Ursache der HFrEF («ischämische Ätiologie») und sollte im Verlauf des Abklärungsgangs immer gesucht werden, entweder mittels invasiver Koronarangiografie, Computertomografie-Koronarangiografie oder eines bildgebenden Ischämietests. Da eine kausale Therapie der HFrEF neben der medikamentösen Basistherapie immer anzustreben ist, muss eine Revaskularisation in Abhängigkeit vom Ausmass der Koronaren Herzkrankheit und von Viabilität/Ischämie erwogen werden. Die Evidenz für die Revaskularisation in diesem Setting ist allerdings bescheiden und liegt eigentlich nur für die Bypass-Chirurgie vor (eine randomisierte Studie, Klasse-IIa-Empfehlung) [1, 39]. Nicht alle HFrEF-Kranken sind aber Kandidatinnen und Kandidaten für eine Bypass-Operation (hohes Operationsrisiko), und die perkutane Koronarintervention hat in den letzten Jahren enorme Fortschritte gemacht. Eine interventionelle Revaskularisation ist somit durchaus eine Alternative, wenn auch die Resultate von randomisierten Studien aktuell ausstehend sind (Klasse-IIb-Empfehlung) [1, 40].
Pulmonalvenenisolation
Vorhofflimmern ist sehr häufig bei HFrEF, ist meist die Folge der linksventrikulären Dysfunktion mit konsekutiv erhöhtem linksatrialem Druck und kann im Sinne eines Circulus vitiosus zu einer weiteren Verschlechterung der LVEF führen, was wiederum das Vorhofflimmern unterhält etc. Es ist bekannt, dass HFrEF-Patientinnen und Patienten, die sich vom Vorhofflimmern dauerhaft in den Sinusrhythmus bringen lassen, eine bessere Prognose haben als diejenigen, die im Vorhofflimmern bleiben. Somit muss bei jeder Person mit HFrEF und Vorhofflimmern einmal ein Rhythmisierungsversuch erwogen und in Abhängigkeit von den Erfolgschancen (Chronizität, Vorhofgrösse) auch umgesetzt werden. Die Leitlinien empfehlen eine Pulmonalvenenisolation bei HFrEF und Vorhofflimmern (Evidenzklasse IIa), wenn dem Vorhofflimmern eine wichtige Rolle in der Pathogenese der Herzinsuffizienz zugeschrieben wird [1], was wie ausgeführt sehr oft der Fall ist. Zudem benötigen alle mit HFrEF und Vorhofflimmern (auch wenn paroxysmal und/oder Pulmonalvenenisolation erfolgreich) eine orale Antikoagulation, primär mit einem oralen Nicht-Vitamin-K-Antikoagulans (NOAC) [1].
Katheterbasierte Edge-to-Edge-Mitralklappenreparatur
Eine funktionelle (oder sekundäre) Mitralinsuffizienz als Resultat eines linksventrikulären Remodelings ist häufig. Diese ist abzugrenzen von einer degenerativen (oder primären) Mitralinsuffizienz (z.B. Prolaps). Eine Studie hat eine Mortalitätsreduktion durch eine katheterbasierte Mitralklappenreparatur (Transcatheter Edge-to-Edge Repair; TEER, «Mitra-Clip») bei HFrEF und schwerer funktioneller Mitralinsuffizienz nachgewiesen. In dieser Studie bestanden leider signifikante Unterschiede bezüglich der medikamentösen Therapie (ACE-I, Betablocker) insofern, als die Kontroll-Gruppe weniger gut behandelt war. Eine andere Studie mit dem gleichen System in einer nur leicht unterschiedlichen HFrEF-Population fiel neutral aus. Die Leitlinien und ein zusätzlicher Expertenkonsensus empfehlen die Prozedur daher nur für sehr selektionierte HFrEF-Patientinnen und Patienten (Kriterien für Schweregrad der Mitralinsuffizienz, Anwendbarkeit des Device, fehlende koronare Herzkrankheit mit Indikation zur chirurgischen Revaskularisation, hohes Operationsrisiko und maximal ausgebaute medikamentöse Therapie), wobei ein multidisziplinärer «Heart-Team»-Entscheid vorliegen muss [1, 41]. Fairerweise muss festgehalten werden, dass die Ergebnisse der chirurgischen Klappenrekonstruktion bei funktioneller Mitralinsuffizienz auch nicht überzeugend sind.
Transplantation/Assist Device
Optionen explizit für advanced/end-stage HFrEF werden in diesem Artikel nicht diskutiert.
Häufige Probleme
Hypotonie
Insbesondere bei Personen ohne vorbestehende Hypertonie ist der Ausbau der Basisstherapie oft durch eine Hypotonie limitiert. Eine asymptomatische Hypotonie soll abgesehen von den Diuretika nicht zu einer Reduktion der Therapie führen. Im Fall einer symptomatischen Therapie sollen zunächst blutdrucksenkende Medikamente gestoppt werden, welche nicht zwingend notwendig sind (z.B. Amlodipin, Nitrate, Alphablocker). Zudem kann eine Verteilung der Tagesdosis auf eine Morgen- und eine Abenddosis versucht werden, und manchmal ist eine Verlagerung der Hauptmenge der Medikation auf den Abend hilfreich, wenn eher weniger Aktivität gefordert ist. Dies birgt aber die Gefahr, dass Medikamente vergessen werden, da der Ablauf am Abend bei den meisten weniger stark einem fixen Ablauf folgt als am Morgen. Bei CRT-Indikation soll dieser Eingriff relativ frühzeitig erfolgen, da durch Verbesserung des Schlagvolumens der Blutdruck ansteigen und einen weiteren Therapieausbau erlauben kann.
Niereninsuffizienz
Eine begleitende Niereninsuffizienz ist bei HFrEF häufig. Zu bedenken ist, dass viele HFrEF-Medikamente nicht nur kardio- sondern auch nephroprotektiv sind. Ein gewisser Anstieg des Serum-Kreatinins unter der Therapie ist zu erwarten und muss akzeptiert werden. Grundsätzlich gilt, dass ein Anstieg des Kreatinins bei einer klinischen Verbesserung nicht zu einer Reduktion der Therapie führen soll. Die Leitlinien empfehlen, dass ein Anstieg des Kreatinins um 50% über die Baseline oder bis 266mcmol/l (oder eGFR 25ml/min/1,73m2) toleriert wird, bevor die Dosis des ACE-I, ARB oder ARNI reduziert wird [1]. Falls das Kreatinin über 100% der Baseline oder über 310mcmol/l (oder eGFR <20ml/min/1,73m2) ansteigt, soll die Therapie gestoppt werden [1]. Dies sind Richtwerte, die zeigen sollen, dass es kontraproduktiv ist, die Therapie bei jedem Kreatinin-Anstieg zu reduzieren. Wie lange man im Einzelfall mit der Therapieanpassung zuwartet, wird vom Setting (Vorgeschichte, ambulant/stationär) und der Erfahrung der behandelnden Ärztin/des behandelnden Arztes abhängen. Entscheidend ist, dass man sich in jedem Fall frühzeitig Klarheit über den Volumenstatus und allfällige toxische Co-Medikation verschafft. Sowohl eine Hypovolämie (prärenales Problem) als auch eine Hypervolämie (erhöhter zentralvenöser Druck, verminderter transrenaler Druckgradient) können zur einer Verschlechterung der Nierenfunktion führen. Nicht-steroidale Antirheumatika werden häufig ohne Wissen der betreuenden Ärztinnen und Ärzte eingenommen und sind kontraindiziert. Wichtig ist im Kontext der nun «neuen» SGTL-2-Hemmer, dass diese die Progression der Niereninsuffizienz bei HFrEF-Patientinnen und -Patienten bremsen und bis zu einer eGFR von 20–25ml/min/1,73m2 eingesetzt werden sollen.
Hyperkaliämie und Hypokaliämie
Im Fall einer fortgeschrittenen Niereninsuffizienz kann unter ACE-I und MRA eine Hyperkaliämie ein relevantes Problem werden, welches die Therapie limitiert. Analog zur Niereninsuffizienz soll auch eine gewisse Hyperkaliämie akzeptiert werden. Die Leitlinien empfehlen, erst bei einem Kalium >5,5mmol/l eine Dosisreduktion des MRA vorzunehmen bzw. ihn bei einem Kalium >6,0mmol/l zu stoppen. Dies setzt aber ein engmaschiges Monitoring voraus. Neu besteht die Option des gut verträglichen peroralen Kaliumbinders Patiromer, der das Kalium effizient senkt und als Dauertherapie verwendet den Einsatz/die Dosissteigerung eines MRA bei HFrEF-Patientinnen und -Patienten ermöglichen kann [42]. Häufiger und eher unterschätzt ist die Hypokaliämie als Folge einer chronischen Therapie mit Schleifendiuretika. Die Hypokaliämie kann wie die Hyperkaliämie zu ventrikulären Rhythmusstörungen und plötzlichem Herztod bzw. bei geschützten Kranken zu ICD-Interventionen führen [43]. Die Hypokaliämie soll durch Substitution (meist vorübergehend), Reduktion der Schleifendiuretika und Steigerung von ACE-I/ARB/ARN und vor allem des MRA angegangen werden. In seltenen Fällen muss an Laxanzien- und/oder Diuretikaabusus gedacht werden.
Key messages
- •Die Therapie der Herzinsuffizienz mit reduzierter Auswurffraktion (HFrEF) setzt sich neu zusammen aus einer Basistherapie, bestehend aus vier Medikamenten, und weiteren Optionen gemäss Ansprechen auf die Basistherapie.
- •Die Basistherapie umfasst einen Angiotensin-Converting Enzyme Inhibitor, einen Betablocker, einen Mineralokortikoid-Rezeptor-Antagonisten und einen Sodium Glucose Co-Transporter-2 Inhibitor. Diese vier Medikamente werden unabhängig vom Effekt eines anderen Medikaments praktisch zeitgleich eingesetzt und fortlaufend auftitriert.
- •Der Wechsel vom Angiotensin-Converting Enzyme Inhibitor auf den Angiotensin-Rezeptor-Neprilysin-Inhibitor soll standardmässig erfolgen.
- •Optionen für HFrEF-Patientinnen und Patienten mit persistierender Symptomatik nach Etablierung der Basistherapie umfassen zusätzliche Medikamente (Ivabradin, Vericiguat, Digoxin, Eisen) und Devices/Interventionen (kardiale Resynchronisation, Revaskularisation, Pulmonalvenenisolation, interventionelle Mitralklappenrekonstruktion).
Lernfragen
- 1.Was ist korrekt? (Einfachauswahl)
- a)Jede Person mit Herzinsuffizienz mit reduzierter Auswurffraktion (HFrEF) soll mit Digoxin behandelt werden.
- b)Ein Sodium Glucose Co-Transporter-2 Inhibitor darf nur bei HFrEF-Patientinnen und -Patienten mit therapierefraktärer Symptomatik eingesetzt werden.
- c)Der Betablocker soll bei HFrEF möglichst früh eingesetzt und innerhalb von ein bis zwei Wochen auf die Ziel-Dosis auftitriert werden.
- d)Die Umstellung vom Angiotensin-Converting Enzyme Inhibitor auf den Angiotensin-Rezeptor-Neprilysin-Inhibitor ist bei HFrEF-Patientinnen und -Patienten grundsätzlich Standard und nicht therapierefraktären Fällen vorbehalten.
- 2.Was ist nicht korrekt? (Einfachauswahl)
- a)Eine Mineralokortikoid-Rezeptor-Antagonist ist Bestandteil der Basistherapie für Patientinnen und Patienten mit Herzinsuffizienz mit reduzierter Auswurffraktion (HFrEF).
- b)Ein Defibrillator ist vor allem bei HFrEF und nicht-ischämischer Ätiologie indiziert.
- c)Ivabradin ist eine Option für HFrEF-Patientinnen und -Patienten mit optimierter Basistherapie und Herzfrequenz ≥70/min.
- d)Schleifendiuretika sind nicht zwingend Bestandteil der Therapie von HFrEF.
Antworten zu den Lernfragen
1. Antwort d) ist richtig.
2. Antwort b) ist richtig.
Bibliografie
, 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J . 2021;42 :3599–3726.
, 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J . 2016;37 :2129–2200.
. Victims of Success in Failure. Circulation . 2020; 142 :1129–1131.
, Estimating lifetime benefits of comprehensive disease-modifying pharmacological therapies in patients with heart failure with reduced ejection fraction: a comparative analysis of three randomised controlled trials. Lancet . 2020;396 :121–128.
, Do patients have worse outcomes in heart failure than in cancer? A primary care-based cohort study with 10-year follow-up in Scotland. Eur J Heart Fail . 2017:19 :1095–1104.
, Diuretic strategies in patients with acute decompensated heart failure. N Engl J Med . 2011;364 :797–805.
, Relation between dose of loop diuretics and outcomes in a heart failure population: results of the ESCAPE trial. Eur J Heart Fail . 2007;9 :1064–1069.
, Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function intolerant to angiotensin-converting-enzyme inhibitors: the CHARM-Alternative trial. Lancet . 2003;362 :772–776.
, Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med . 2014;371 :993–1004.
, Systolic blood pressure, cardiovascular outcomes and efficacy and safety of sacubitril/valsartan (LCZ696) in patients with chronic heart failure and reduced ejection fraction: results from PARADIGM-HF. Eur Heart J . 2017;38 :1132–1143.
, Effect of sacubitril/valsartan versus enalapril on glycaemic control in patients with heart failure and diabetes: a post-hoc analysis from the PARADIGM-HF trial. Lancet Diabetes Endocrinol . 2017;5 :333–340.
, Angiotensin-Neprilysin Inhibition in Acute Decompensated Heart Failure. N Engl J Med . 2019;380 :539–548.
, 2021 Update to the 2017 ACC Expert Consensus Decision Pathway for Optimization of Heart Failure Treatment: Answers to 10 Pivotal Issues About Heart Failure With Reduced Ejection Fraction: A Report of the American College of Cardiology Solution Set Oversight Committee. J Am Coll Cardiol . 2021;77 :772–810.
, Effect on survival and hospitalization of initiating treatment for chronic heart failure with bisoprolol followed by enalapril, as compared with the opposite sequence: results of the randomized Cardiac Insufficiency Bisoprolol Study (CIBIS) III. Circulation . 2005;112 :2426–2435.
, Efficacy of beta blockers in patients with heart failure plus atrial fibrillation: an individual-patient data meta-analysis. Lancet . 2014;384 :2235–2243.
, The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med . 1999;341 :709–717.
, Eplerenone in patients with systolic heart failure and mild symptoms. N Engl J Med . 2011;364 :11–21.
, Reduced Risk of Hyperkalemia During Treatment of Heart Failure With Mineralocorticoid Receptor Antagonists by Use of Sacubitril/Valsartan Compared With Enalapril: A Secondary Analysis of the PARADIGM-HF Trial. JAMA Cardiol 2017;2 :79–85.
, Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med . 2019;381 :1995–2008.
, Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med . 2020;383 :1413–1424.
, SGLT2 inhibitors in patients with heart failure with reduced ejection fraction: a meta-analysis of the EMPEROR-Reduced and DAPA-HF trials. Lancet . 2020;396 :819–829.
. SGLT2 inhibitors and mechanisms of cardiovascular benefit: a state-of-the-art review. Diabetologia . 2018;61 :2108–2117.
, Effect of Empagliflozin on Left Ventricular Volumes in Patients With Type 2 Diabetes, or Prediabetes, and Heart Failure With Reduced Ejection Fraction (SUGAR-DM-HF). Circulation . 2021;143 :516–525.
, Randomized Trial of Empagliflozin in Nondiabetic Patients With Heart Failure and Reduced Ejection Fraction. J Am Coll Cardiol . 2021;77 :243–255.
. Simultaneous or Rapid Sequence Initiation of Quadruple Medical Therapy for Heart Failure-Optimizing Therapy With the Need for Speed. JAMA Cardiol . 2021;6 :743–744.
, Withdrawal of pharmacological treatment for heart failure in patients with recovered dilated cardiomyopathy (TRED-HF): an open-label, pilot, randomised trial. Lancet . 2019;393 :61–73.
, Selective Heart Rate Reduction With Ivabradine Increases Central Blood Pressure in Stable Coronary Artery Disease. Hypertension . 2016;67 :1205–1210.
, Ivabradine and outcomes in chronic heart failure (SHIFT): a randomised placebo-controlled study. Lancet . 2010;376 :875–885.
, Vericiguat in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med . 2020;382 :1883–1893.
, N-Terminal Pro-B-Type Natriuretic Peptide and Clinical Outcomes: Vericiguat Heart Failure With Reduced Ejection Fraction Study. JACC Heart Fail . 2020;8 :931–939.
, Chronic Oral Study of Myosin Activation to Increase Contractility in Heart Failure (COSMIC-HF): a phase 2, pharmacokinetic, randomised, placebo-controlled trial. Lancet . 2016;388 :2895–2903.
, Cardiac Myosin Activation with Omecamtiv Mecarbil in Systolic Heart Failure. N Engl J Med . 2021;384 :105–116.
, Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med . 2009;361 :2436–2448.
, Ferric carboxymaltose for iron deficiency at discharge after acute heart failure: a multicentre, double-blind, randomised, controlled trial. Lance.t 2020;396 :1895–1904.
, Effect of Oral Iron Repletion on Exercise Capacity in Patients With Heart Failure With Reduced Ejection Fraction and Iron Deficiency: The IRONOUT HF Randomized Clinical Trial. JAMA . 2017;317 :1958–1966.
. The effect of digoxin on mortality and morbidity in patients with heart failure. N Engl J Med . 1997;336 :525–533.
. Should we SHIFT our thinking about digoxin? Observations on ivabradine and heart rate reduction in heart failure. Eur Heart J . 2012;33 :1137–1141.
, Defibrillator Implantation in Patients with Nonischemic Systolic Heart Failure. N Engl J Med . 2016;375 :1221–1230.
, Coronary-artery bypass surgery in patients with left ventricular dysfunction. N Engl J Med . 2011;364 :1607–1616.
, Impact of Percutaneous Coronary Intervention on Outcomes in Patients With Heart Failure: JACC State-of-the-Art Review. J Am Coll Cardiol . 2021;77 :2432–2447.
, The management of secondary mitral regurgitation in patients with heart failure: a joint position statement from the Heart Failure Association (HFA), European Association of Cardiovascular Imaging (EACVI), European Heart Rhythm Association (EHRA), and European Association of Percutaneous Cardiovascular Interventions (EAPCI) of the ESC. Eur Heart J . 2021.
. Patiromer and medication optimisation in heart failure with reduced ejection fraction: a Swiss perspective. Swiss Med Wkly . 2020;150 :w20362.
. Hypokalaemia and sudden cardiac death – lessons from implantable cardioverter defibrillators. Emerg Med J . 2007;24 :206–208.